1. Perhatikan data percobaan penambahan sedikit air, sedikit asam dan sedikit basa pada lima macam larutan berikut ini.
Dari data yang diperoleh pada percobaan di atas, tentukan larutan mana yang termasuk larutan penyangga!
2. Dicampurkan dua larutan yaitu 50 mL NaOH 0,1 M dan 50 mL CH3COOH 0,2 M. Tentukan apakah campuran tersebut membentuk larutan penyangga atau tidak!
3. Terdapat beberapa larutan berikut: (1) 25 mL NaOH 0,1 M;
(2) 25 mL HCN 0,2 M;
(3) 25 mL CH3COOH 0,1 M; (4) 25 mL NH4OH 0,2 M; dan (5) 25 mL HCl 0,2 M.
Pasangan senyawa yang dapat membentuk larutan penyangga adalah...
A. (1) dan (2) B. (1) dan (3) C. (2) dan (4) D. (3) dan (4) E. (4) dan (5)
4. 4. 0,15 mol asam asetat (CH3COOH, Ka = 2 × 10 − 5) dan
0,10 mol NaOH dilarutkan dalam air sehingga diperoleh larutan penyangga dengan volume 1 liter. Tentukan pH larutan penyangga tersebut!
5. Sebanyak 200 mL larutan HCOOH 0,1 M direaksikan dengan
50 mL larutan NaOH 0,2 M. Bila Ka HCOOH = 2 × 10−4 dan log 2 = 0,3, harga pH larutan setelah reaksi adalah....
B. 3,7
C. 4,3
D. 4,7
E. 5,3
6. Larutan 100 mL HCOOH 0,3 M (Ka = 2 × 10−4) dicampur dengan 100 mL larutan KOH 0,1 M. Tentukan harga pH larutan!
7. 100 mL NH4OH 0,1 M (Kb = 10−5) dicampurkan dengan 50 mL HCl 0,1 M. Tentukan pH larutan!
8. 150 mL NH3 0,2 M (Kb = 10−5) dicampurkan dengan 100 mL HNO3 0,1 M. Tentukan pH larutan jika log 2 = 0,3!
9. pH larutan dari campuran 100 mL larutan NH4OH 0,1 M dengan 100 ml larutan NH4Cl 0,1 M (Kb NH4OH = 10−5) adalah....
A. 5
B. 6
C. 7
E. 9
10. Diberikan campuran dari beberapa larutan sebagai berikut:
(1) 200 mL CH3COOH 0,1 M dan 200 mL NaOH 0,1 M (2) 200 mL CH3COOH 0,2 M dan 200 mL NaOH 0,1 M (3) 200 mL NH4OH 0,1 M dan 200 mL HCl 0,1 M
(4) 200 mL NH4OH 0,1 M dan 200 mL HCl 0,05 M
Campuran yang membentuk larutan penyangga adalah... A. 1, 2, dan 3
C. 2 dan 4
D. 4
E. 1, 2, 3, dan 4
JAWABAN
1. Ciri-ciri larutan penyangga:
- Saat ditambah sedikit air atau sedikit basa atau sedikit asam nilai pH
relatif tetap, jika terjadi perubahan relatif kecil.
Yang paling mendekati adalah larutan Q dan larutan S.
2. Tentukan dulu jumlah mol masing-masing dengan mengalikan volume dan molaritasnya:
50 mL NaOH 0,1 M
Jumlah mol = 50 x 0,1 = 5 mmol
50 mL CH3COOH 0,2 M
Jumlah mol = 50 x 0,2 = 10 mmol
-Setelah tahu molnya, cek reaksinya apakah ada sisa asam lemahnya atau sisa CH3COOH
Terdapat sisa CH3COOH sebanyak 5 mmol, berarti campuran tersebut membentuk suatu larutan penyangga.
3. Larutan penyangga dapat diperoleh dari reaksi asam lemah + basa kuat atau asam kuat + basa lemah yang di akhir reaksi tersisa asam lemahnya atau basa lemahnya
Cek reaksi pilihan 1 dan 2 apakah menyisakan asam lemah atau basa lemah:
Tersedia:
25 mL NaOH 0,1 M → 2,5 mmol
25 mL HCN 0,2 M → 5 mmol
Reaksinya:
Nampak tersisa HCN sebanyak 2,5 mmol yang berarti terbentuk larutan penyangga.
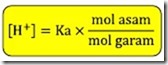
4. Data:

Tersisa 0,05 mol CH3COOH (asam lemah) dan 0,10 mol CH3COONa (garam). Dari sini dapat ditentukan [H+] dengan rumus berikut:
Sehingga [H+] nya
Terakhir, pH larutan adalah:
pH = − log [H+]
= − log 10 −5
= 5
5. Data:
200 mL larutan HCOOH 0,1 M → 20 mmol
50 mL larutan NaOH 0,2 M → 10 mmol
Reaksi yang terjadi sebagai berikut:
Tersisa 10 mmol HCOOH dan 10 mmol HCOONa
Sehingga [H+] nya
Terakhir, pH larutan adalah:
pH = − log [H+] = − log (2 × 10 −4)
= 4 − log2 = 4 − 0,3
= 3,7
6. Data:
100 mL HCOOH 0,3 M → 30 mmol
100 mL larutan KOH 0,1 M → 10 mmol
Reaksi yang terjadi adalah sebagai berikut:

Terakhir, pH larutan adalah:
pH = − log [H+] = − log (4 × 10−4)
= 4 − log 4
7. Data:
100 mL NH4OH 0,1 M → 10 mmol
50 mL HCl 0,1 M → 5 mmol
Reaksi yang terjadi adalah sebagai berikut:
Tersisa 5 mmol NH4OH (basa lemah) dan 5 mmol NH4Cl.
Menentukan [OH−] dari rumus:
sehingga [OH−]
pOH larutan = − log [OH−]
= −log 10−5
= 5
Jadi pH = 14 − 5 = 9
8. Data:
150 mL NH3 0,2 M → 30 mmol
100 mL HNO3 0,1 M → 10 mmol
Reaksi yang terjadi adalah sebagai berikut:

pOH larutan = − log [OH−]
= −log (2 × 10−5)
= 5 − log 2 = 5 − 0,3 = 4,7
Jadi pH = 14 − 4,7 = 9,3
9. Data:
100 mL NH4OH 0,1 M → 10 mmol
100 mL NH4Cl 0,1 M → 10 mmol
[OH−] dan pOH nya:
pH larutan = 14 − 5
= 9
10.Asam-asam maupun basa yang terlibat memiliki valensi yang sama, satu.
Tinggal dilihat dari masing-masing campuran perbandingan molnya untuk melihat ada tidaknya sisa dari asam lemah atau basa lemahnya.
Jawab 2 dan 4.















0 Komentar untuk "SOAL DAN PEMBAHASAN KIMIA MATERI LARUTAN BUFFER"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)