1. Pada elektrolisis Al2O3 (pengolahan Aluminium) sebanyak 102 kg dihasilkan Al …. (Al = 27, O =16)
A. 102 kg D. 30 kg
B. 80 kg E. 12 kg
C. 54 kg
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1988
Penyelesaian :
Al2O3
102 kg = 102000 gram
1 mol Al2O3 dihasilkan 2 mol Al3+
1000 mol Al2O3 dihasilkan 2000 mol Al3+
3e + Al3+ Al
1 mol Al3+ ~ 1 mol Al
2000 molAl3+ ~ 2000 mol Al
Jadi yang terjadi = 2000 mol
= 2000 x 27 gram
= 54.000 gram = 54 kg
2. Logam Mg dapat digunakan sebagai pelindung katodik terhadap logam Fe.
SEBAB
Logam Mg letaknya disebelah kanan Fe dalam deret volta.
Jawaban : C
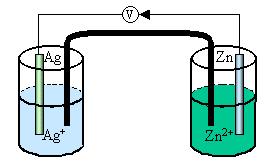
SMU/Ebtanas/Kimia/Tahun 1988
Penyelesaian :
Logam yang dapat dipakai sebagai pelindung katodik, adalah logam yang bersifat reaktif dari pada yang dilindungi.
Logam Mg lebih reaktif dari logam Fe, sebab Mg terletak di sebelah kiri logam Fe dalam deret volta.
Deret Volta : K Ba Ca Mg Al Zn Fe Ni Sn Pb H Cu H Ag Pt Au
3. Pada elektrolisis seperti gambar di bawah ini persamaan yang menunjukkan reaksi pada elektroda X adalah ….
D. 2H2O(l) + 2e- H2(g) + 2OH-(ag)
E. 2H2O(l) + O2(l) + 4e- 4OH-(ag)
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1989
Penyelesaian :
Reaksi anoda = Cu Cu2+ + 2e
Reaksi katoda = 2e + Cu2+ Cu
reaksi pada x adalah oksidasi pada anion.
4. Data tabel E sel dalam volt. Pada tabel berikut harga E sel : Mg/Mg+2//Pb+2/Pb adalah ….
A. -2, 21 volt D. 2, 21 volt
B. -2, 47 volt E. 2, 68 volt
C. 2, 47 volt
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1989
Penyelesaian :
5. Untuk mencegah terjadinya korosi pipa besi yang ditanam dalam tanah, pipa besi dihubungkan dengan logam ….
A. Mg B. Li C. Ag D. Pb E. Sn
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1989
Penyelesaian :
Untuk melindungi besi dari korosi, maka di sekitar besi ditempatkan logam-logam yang memiliki Eo lebih kecil yaitu terletak sebelah kiri dari besi dari deret volta.
Deret volta: Li, K, Ba, Ca, Na, Mg , Al, Mn, Zn, Cr, Fe , Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
6. Diketahui potensial elektroda :
Ag- (aq) + e Ag (s) E0 = + 0,80 volt
Ln3- (aq) + 3e Ln (s) E0 = -0,34 volt
Mn2-(aq)+2e Mg(s) E0 =-2,34 volt
Mn2- (aq) + 2e Mn (s) E0 = -1,20 volt
Dua setengah sel di bawah ini yang potensialnya paling besar adalah ….
A. Mg/Mg2+//Ag+/Ag D. Mn/Mn2+//Mg2+//Mg
B. Ag/Ag+//Mg2+Mg E. Ag/Ag+//Ln2+/Ln
C. Mn/Mn2+//Ln3+/Ln
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
Mg Mg2+ + 2e = 2,34
Ag+ + e Ag = 0,80 +
3,14 (paling besar)
7. Diketahui potensial elektroda :
Cr3+(aq) + 3e Cr(s) E° = -0,71 volt
Ag+(s) + e Ag(s) E° = +0,80 volt
Al3+(aq) + 3e Al(s) E° = -1,66 volt
Zn3+(aq) + 2e Zn(s) E° = -0,74 volt
Pt2+(aq) + 2e Pt(s) E° = +1,50 volt
Reaksi-reaksi yang berlangsung adalah ….
A. Zn3+(aq) + Pt(s) Pt2+(aq) + Zn(s)
B. Ag(s) + Cr3+(aq) Ag+(s) + Cr(s)
C. Al3+(aq) + Cr(s) Al(s) + Cr3+(aq)
D. Pt(s) + Ag+(aq) Ag(s) + Pt2+(aq)
E. Cr3+(aq) + Al(s) Al3+(aq) + Cr(s)
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
A. 
8. Waktu yang diperlukan untuk melapisi suatu permukaan besi dengan 3,05 gram air seng dalam larutan ion seng yang dialirkan arus listrik sebesar 5 ampere adalah …. (F = 96500, Ar Zn = 65,4)
A. 4 menit 2 detik D. 375 menit 2 detik
B. 15 menit 15 detik E. 30 menit 0 detik
C. 60 menit 0 detik
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
I = 5 ; V = Valensi seng = 2
Berat = 3,05
3,05
9. Reaksi yang terjadi pada katode dari elektrolisis larutan Na2SO4 adalah ….
A. 2H2O (aq) + 2e 2OH- (aq) + H2 (g)
E. 4OH- (aq) 2H2O (aq) + O2 (g) + 4e
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
Na2SO4 2Na+ + SO42-
Pada katoda : 2H2O + 2e 2OH- + H2
anoda : 2H2O 4H+ + O2 + 4e
10. Pada elektrolisis larutan garam logam alkali atau alkali tanah tidak dihasilkan logamnya karena ….
A. sifat oksidatornya lemah
B. sifat reduktornya lemah
C. garam halidanya mempunyai titik leleh tinggi
D. energi ionisasi tinggi dari logam lain
E. ion logamnya tidak mengalami reduksi
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
Pada elektrolisis larutan garam logam Alkali atau Alkali tanah tidak menghasilkan logam sebab :
- harga E° lebih kecil dari E° air
- ion logamnya tidak mengalami reduksi
11. Bila diketahui potensial elektroda standar :
Al3+ (aq) + 3e Al (s) E° = -1,76 volt
Zn2+ (aq) + 2e Zn (s) E° = -0,76 volt
Fe2+ (aq) + 2e Fe (s) E° = -0.44 volt
Cu2+ (aq) + 2e Cu (s) E° = +0,34 volt
Bagan sel volta yang E° selnya paling besar adalah ….
A. Al/Al3+//Zn2+/Zn D. Al/Al3+//Cu2+/Cu
B. Fe/Fe2+//Al3+/Al E. Al3+/Al//Cu2+/Cu
C. Zn/Zn2+//Cu2+ /Cu
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
12. Bila diketahui potensial elektroda standar :
Pb2+ (aq) + 2e Pb (s) E° = -0,13 volt
Fe2+ (aq) + 2e Fe (s) E° = -0, 44 volt
Mg2+ (aq) + 2e Mg (s) E° = -2,34 volt
Bagan sel volta yang E° selnya paling besar adalah ….
A. Cu(s) + Mg2+(aq) Cu2+(aq) + Mg(s)
B. Mg(s) + Cu2+(aq) Mg2+(aq) + Cu(s)
C. Pb(s) + Cu2+(aq) Mg2+(aq) + Cu(s)
D. Fe(s) + Mg2+(aq) Fe2+(aq) + Mg(s)
E. Mg(s) + Pb2+(aq) Mg2+ + Pb(s)
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
13. Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah ….
A. Pt dan C D. Zn dan Cu
B. Zn dan C E. Pb dan PbO2
C. Pb dan PbO2
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1992
Penyelesaian :
Reaksi aksi
Pb + PbO2 + H2SO4
Pemakaian
PbSO4 + H2O
Pengisian
14. Diketahui data potensial standar berikut :
Zn2+ (aq) + 2a Zn (s) Eo = 0,76 volt
Cu2+ (aq) + 2e Cu (s) Eo = + 0,34 volt
Mg2+ (aq) + 2e Mg (s) Eo = - 2,34 volt
Cr3+(aq) + 3e Cr (s) Eo = - 0,74 volt
Harga potensial sel (E° sel) yang paling kecil terdapat pada ….
A. Zn / Zn2+ (aq) // Cu2+(aq) / Cu
B. Zn / Zn2+ (aq) // Cr3+(aq) / Cr
C. Mg / Mg2+ (aq) // Cr3+ (aq) / Cr
D. Cr / Cr3+ (aq) // Cu2+ (aq) / Cu
E. Mg / Mg2+(aq) // Cu2+(aq) / Cu
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1992
Penyelesaian :
Zn / Zn2+ (aq) // Cr3+(aq) / Cr
15. Berapakah massa logam perak yang diendapkan jika arus listrik sebesar 5 Ampere dialirkan ke dalam larutan AgNO3 selama 2 jam …. (Ar : Ag = 108)
A. 24,90 gram D. 42,09 gram
B. 29,40 gram E. 49,20 gram
C. 40,29 gram
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1992
Penyelesaian :
16. Pada saat sel aki bekerja, reaksi yang terjadi pada katode adalah ….
A. Pb(s) + SO42-(aq) PbSO4(s) + 2e
C. PbO2 (s) + 4H+ (aq) + SO42- (aq) + 2e PbSO4 (s) + H2O (l)
D. Pb2+ (aq) + O2 (g) PbO2 (s)
E. H2SO4 (aq) 2H+(aq) + SO42- (aq)
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1993
Penyelesaian :
Reaksi : PbO2 (s) + 4H+ (aq) + SO42- (aq) + 2e PbSO4 (s) + H2O (l)
17. Perhatikan bagan elektrolisis berikut ini :
Elektrode yang menghasilkan gas adalah ….
A. I dan II D. III dan V
B. III dan IV E. II dan IV
C. V dan VI
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1993
Penyelesaian :
nggak ada jawaban
18. Supaya pipa air yang terbuat dari besi tidak berkarat, pipa tersebut dihubungkan dengan logam ….
A. Perak D. timah
B. Tembaga E. magnesium
C. Timbal
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1993
Penyelesaian :
19. Siswa melakukan eksperimen terhadap 5 batang paku yang diletakkan dalam 5 tabung reaksi.
(1) Paku dalam tabung 1 di cat dulu
(2) Tabung reaksi 2 berisi udara kering dan tertutup
(3) Paku dalam tabung 3 dilumuri lemak dulu
(4) Tabung reaksi 4 berisi udara lembab dan tertutup
(5) Tabung reaksi 5 berisi minyak tanah dan tertutup
Proses korosi terjadi pada percobaan ….
A. (1) dan (2) D. (2) dan (4)
B. (1) dan (3) E. (1) dan (5)
C. (2) dan (3)
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 1994
Penyelesaian :
Proses Korosi : proses terjadinya perkaratan antara logam dengan udara atau air.
20. Perhatikan gambar elektrolisis berikut ini :
Elektrolisis yang menghasilkan gas H2 ditunjukkan pada gambar ….
A. 1 dan 2 D. 2 dan 4
B. 2 dan 3 E. 1 dan 4
C. 3 dan 4
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1995
Penyelesaian :
Elektrolisis NaCl
Katoda : 2H2O + 2e- 2OH- + H2 (g)
Anoda : 2Cl- Cl2 + 2e-
Elektrolisis KNO3
Katoda : 2H2O 2OH- + H2 (g)
Anoda : 2H2O 4H+ + O2 (g)
21. Bagan penulisan sel yang benar sesuai gambar di berikut adalah ….
A. Zn(s) / Zn2+(aq) // Ag+(aq) / Ag(s)
B. Zn2+(aq) / Zn(s) // Ag(aq) / Ag+(s)
C. Ag(s) / Ag+(aq) // Zn2+(aq) / Zn(s)
D. Ag(s) / Ag+(aq) // Zn(s) / Zn2+(aq)
E. Ag+(aq) / Ag(s) // Zn2+(aq) / Zn(s)
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1996
Penyelesaian :
Ag+ sebagai anoda (terjadinya reaksi reduksi)
Ag+ + e- Ag
Zn2+ sebagai katoda (terjadinya reaksi oksidasi)
Zn Zn2+ + 2e
22. Diketahui :
Fe2+ (aq) + 2e Fe (s) E° = 0,44 volt
Ne2+ (aq) + 2e Ne (s) E° = -0,25 volt
Sn2+ (aq) + 2e Sn (s) E° = -0,14 volt
Pb2+ (aq) + 2e Pb (s) E° = -0,13 volt
Mg2+ (aq) + 2e Mg (s) E° = -0,38 volt
Cu2+ (aq) + 2e Cu (s) E° = 0,34 volt
Berdasarkan E° di atas. Logam yang dapat memberikan perlindungan katodik pada besi adalah ….
A. Ne B. Sn C. Pb D. Mg E. Cu
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1997
Penyelesaian :
23. Pada elektrolisis larutan perak nitrat dengan menggunakan elektrode karbon, persamaan reaksi yang terjadi pada anode adalah ….
B. 2e + 2H2O (aq) 2OH- (aq) + H2O (g)
C. 2H2O (aq) 4H+ (aq) + O2 (g) + 4e
E. 2NO3-(aq) 2NO2(g) + O2 (g)+ 2e
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1997
Penyelesaian :
Larutan AgNO3 Ag+ + NO3- 1x4
Katoda = 4Ag (s)
Anoda = 4HNO3 + O2 (g)
24. Elektrolisis larutan yang menghasilkan logam alkali adalah ….
A. leburan AlCl3 dengan elektrode Pt
B. larutan KI dengan elektrode C
C. larutan Na2SO4 dengan elektrode C
D. larutan KNO3 dengan elektrode Au
E. leburan NaCl dengan elektrode C
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1997
Penyelesaian :
elektron leburan NaCl dengan elektroda C
25. Dari dua macam sifat fisis unsur-unsur : 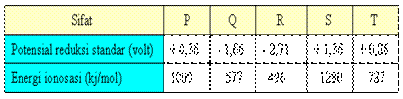
A. P B. Q C. R D. S E. T
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 1997
Penyelesaian :
Oksidator kuat bila potensial reduksi besar oksidator
terkuat adalah unsur S potensial reduksi = + 1,36
26. Penulisan lambang sel yang tepat dari gambar sel di bawah ini adalah ….
A. Cu(s)/Cu2+(aq)// Zn (s)/ Zn2+(aq)
B. Zn (s)/Zn2+(aq)//Cu2+(aq)/Cu(s)
C. Cu2+(s)/Cu(s)//Zn2+(aq)/Zn(s)
D. Zn2+(aq)/Zn//Cu(s)/Cu2+(aq)
E. Zn(s)/Zn2+(aq)//Cu(s)/Cu2+(aq)
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 1998
Penyelesaian :
Elektroda (+) anoda : terjadi reaksi oksidasi : Cu
Cu2+ + 2e
(-) katoda : terjadi reaksi reduksi 2e + Zn2+
Zn
Zn2+(aq)/Zn(s)//Cu(s)/Cu2+(aq)
27. Elektrolisis terhadap larutan di bawah ini yang menghasilkan gas pada kedua elektrode karbonnya, adalah ….
A. NaCl (aq) D. NiCl2 (aq)
B. CuSO4 (aq) E. SnSO4 (aq)
C. AgNO3
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1998
Penyelesaian :
Larutan NaCl Na+ + Cl- | x 2|
28. Diketahui potensial reduksi standar untuk:
Fe3+ / Fe2+ = + 0,77 volt; Zn 2+ / Zn = -0,76 volt
Br2 / Br = +1,07 volt; Cu2+/ Cu = + 0,34 volt
I / I- = + 0,54 volt;
Reaksi berikut yang mempunyai potensial terkecil adalah ….
A. 2 Fe2+ (aq) + Br2 (aq) 2 Fe3+ (aq) + 2 Bi (aq)
B. 2 Fe3 (aq) + 2 Br (aq) 2 Fe2+ (aq) + Br2 (l )
C. 2 Fe3+ (aq) + 2I-(aq) 2 Fe2+ (aq) + I2 (s)
D. Br2 (aq) + 2I (aq) 2Br (aq) + I2 (s)
E. Zn (s) + Cu2+ (aq) Cu (s) + Zn2+ (aq)
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1999
Penyelesaian :
A. - 0,77 + 1,07 = + 0,3
B. + 0,77 - 1,07 = - 0,3
C. + 0,77 - 0,54 = + 0,23
D. 1,07 - 0,54 = 0,53
E. + 0,76 + 0,34 = 1,1
29. Arus listrik 10 ampere dialirkan ke dalam larutan AgNO3 selama 965 detik. Massa perak yang dihasilkan pada katoda adalah …. (Ar : Ag =108,1 F = 96500 C/mol)
A. 2,7 gram D. 27 gram
B. 5,4 gram E. 54 gram
C. 10,8 gram
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1999
Penyelesaian :
30. Diketahui :
Cu2+(aq) + 2e- Cu(s) E° = +0,34 volt
Fe3+(aq) + e- Fe2+(aq) E° = +0,77 volt
Pb2+(aq) + 2e- Pb(s) E° = -0,13 volt
Cu2+(aq) + e- Cu+(aq) E° = +0,15 volt
Berdasarkan data tersebut, reaksi sel yang tidak dapat berlangsung adalah ….
A. Fe3+(aq) + Pb(s) Fe2+(aq) + Pb2+(aq)
B. Cu2+(aq) + Pb(s) Cu+(aq) + Pb2+(aq)
C. Pb2+(aq) + Cu(s) Pb(aq) + Cu2+(aq)
D. Fe3+(aq) + Cu(s) Fe2+(aq) + Cu2+(aq)
E. Fe3+(aq) + Cu+(s) Fe2+(aq) + Cu2+(aq)
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Reaksi sel yang tidak dapat berlangsung adalah E° bermuatan negatif.
31. Pada elektrolisis larutan H2SO4dengan elektroda Pt, reaksi yang berlangsung di anoda adalah ….
A. H(g) H+(aq) + e-
B. H2(g) 2H+(aq) + 2e-
C. 2H+(aq) + 2e- H2(g)
D. 2H2O(l) 4H+(aq) + O2(g) + 4e-
E. 2H2O(l) + 2e- H2(g) + 2OH-(aq)
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Elektrolisa larutan H2SO4dengan elektroda Pt
32. Pada elektrolisis larutan ZnCl2 (Ar : Zn = 65) dengan, elektroda C menggunakan arus sebesar 4 selama 30 menit, menghasilkan endapan Zn di katoda sebanyak ….
A. 1,2 gram D. 24,2 gram
B. 2,4 gram E. 32,5 gram
C. 4,8 gram
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Zn2++ 2e- Zn (katoda) n = 2
Arus (I) = 4 Ampere
Waktu (t) = 30 x 60 detik = 1800 detik
Ar Zn = 65
33. Diketahui data dari E° reduksi beberapa ion logam :
E° Sn2+= -0,14 volt
E° Mg2+= -2,37 volt
E° Cu2+= +0,34 volt
E° Fe2+= -0,44 volt
E° Ni2+= -0,25 volt
E° Pb2+= -0,13 volt
Logam yang dapat mencegah terjadinya korosi besi secara katodik adalah ….
A. Mg B. Cu C. Sn D. Ni E. Pb
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Logam yang dapat mencegah terjadinya korosi secara katodik adalah Mg karena Mg lebih reaktif dari logam yang lainnya maka Mg akan mengalami reaksi oksidasi lebih dahulu.
34. Diketahui potensial elektroda :
F2(g) + 2e 2F-(aq) E° = +2,87 volt
Cl2(g) + 2e 2Cl-(aq) E° = +1,36 volt
Br2(l) + 2e 2Br-(aq) E° = +1,06 volt
I2(S) + 2e 2I-(aq) E° = +0,54 volt
Harga potensial elektroda : F2(g) + 2Cl-(aq) Cl2(g) + 2F-(aq) adalah ….
A. 1,51 volt D. 3,41 volt
B. 1,90 volt E. 3,39 volt
C. 2,42 volt
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Harga potensial sel untuk reaksi :
35. Pada leburan bauksit (Al2O3) dalam kreolit cair dialiri arus besar 9,65 ampere selama 6 jam jika diketahui Ar : Al = 27, massa logam Al yang terbentuk di katoda sebanyak ….
A. 0,324 gram D. 19,44 gram
B. 1,944 gram E. 58,32 gram
C. 16,20 gram
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
36. Diketahui :
Li2+(aq) + 2e Li(s) E° = -0,14 volt
Fe2+(aq) + 2e Fe(s) E° = -0,44 volt
Cu2+(aq) + 2e Cu(s) E° = +0,34 volt
Pb2+(aq) + 2e Pb(s) E° = -0,13 volt
Mg2+(aq) + 2e Mg(s) E° = -2,38 volt
Ni2+(aq) + 2e Ni(s) E° = -0,25 volt
Logam yang dapat mencegah korosi pada pipa besi adalah ….
A. Timah D. tembaga
B. Nikel E. magnesium
C. Timbal
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 2001
Penyelesaian :
Logam yang dapat mencegah korosi dari pipa besi adalah logam yang memiliki harga E° lebih kecil dari besi yaitu logam magnesium (Mg), karena lebih mudah mengalami oksidasi.
37. Arus listrik 10 ampere dialirkan ke dalam larutan AgNO3 selama 965 detik. Massa perak yang dihasilkan pada katoda adalah …. (Ar : Ag = 108)
A. 2,7 gram D. 27 gram
B. 5,4 gram E. 54 gram
C. 10,8 gram
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 2001
Penyelesaian :
Elektrolisis AgNO3
Massa perak di katoda = .... ?
i = 10 ampere
t = 965 detik
38. Elektrolisis larutan KCl menggunakan elektroda karbon akan menghasilkan ….
A. Logam K di katoda D. Gas Cl2 di katoda
B. Gas H2 di katoda E. larutan basa di anoda
C. Gas O2 di anoda
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 2002
Penyelesaian :
KCl K+ + Cl- x 2
2 KCl 2 K+ + 2 Cl-
Katoda : 2 H2O + 2e H2 + 2 OH-
Anoda : 2 Cl- Cl2 + 2e-
Pada bagian katoda menghasilkan Gas H2.
39. Diketahui potensial elektroda dari :
Al3+ + 3e Al E° = -1,66 volt
Fe2+ + 2e Fe E° = -0,44 volt
Reaksi redoks :
2 Al (aq) + 3 Fe2+ (aq) 2 Al3+ (aq) + 3 Fe (s)
menghasilkan potensial sel sebesar ….
A. +2,10 volt D. -1,22 volt
B. +2,00 volt E. -2,10 volt
C. +1,22 volt
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 2002
Penyelesaian :
(1) Al3+ + 3e Al E° = +1,66 volt
(2) Fe2+ + 2e Fe E° = -0,44 volt
Untuk membentuk reaksi : 2 Al (aq) + 3 Fe2+ (aq) 2 Al3+ (aq) + 3 Fe (s)
Reaksi (1) dibalik :
Al Al3+ + 3e E° = +1,66 volt x 2
Fe2+ + 2e Fe E° = -0,44 volt x 3
2Al 2Al3+ + 6e E° = +3,32 volt
3Fe2+ + 6e 3Fe E° = -1,32 volt
2Al + 3Fe2+
2Al3+ + 3 Fe E° = +2,00 volt
40. Pada reaksi elektrolisa larutan NiSO4 dengan elektroda Ag. Reaksi yang terjadi pada anoda adalah ….
A. Ni2+ (aq) + 2e Ni (s)
B. Ag (aq) Ag+ (aq) + e
C. Ni (s) Ni2+ (aq) + 2e
D. 2 H2O (l) + 2e H2 (g) + 2 OH- (aq)
E. 2 H2O (l) 4 H+ (aq) + O2 (g) + 4e
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 2002
Penyelesaian :
Reaksi Elektrolisis larutan NiSO4 dengan elektroda Ag
NiSO4(aq) Ni+2(aq) + SO4-2(aq)
Sisa asam dari (SO4-2, NO3-, PO4-3) tidak dioksidasi yang mengalami oksidasi adalah pelarut air.
Anoda (oksidasi) : 2 H2O(aq) 4 H+(aq) + O2(g) + 4e
41. Jika diketahui potensial elektroda standard dari :
Ag+(aq) + e Ag(s) E° = +0,80 volt
In3+(aq) + 3e In(s) E° = -0,34 volt
Mg2+(aq) + 2e Mg(s) E° = -2,37 volt
Mn2+(aq) + 2e Mn(s) E° = -1,20 volt
Pasangan yang memberikan perbedaan potensial sebesar +1,14. volt adalah ….
A. Ag Ag+ dan Mn2+
Mn
B. In In3+ dan Ag+
Ag
C. Mn Mn2+ dan Mg2+
Mg
D. Ag Ag+ dan In3+
In
E. Mg Mg2+ dan Ag+
Ag
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 2003
Penyelesaian :
In In3+ E° = +0,34 volt
Ag+ Ag E° = + 0,80 volt
In + Ag+ In3+ + Ag Esel = 1,14 volt
42. Perhatikan gambar berikut :

Peristiwa elektrolisasi dari ke lima gambar di atas yang menghasilkan gas pada suhu kamar di kedua elektrodanya adalah ….
A. 1 dan 2 D. 4 dan 5
B. 2 dan 4 E. 1 dan 3
C. 3 dan 5
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 2003
Penyelesaian :
Reaksi-reaksi yang terjadi pada masing-masing elektrodanya adalah :
1. Larutan NaCl
Katoda : Na+ + e Na
Anoda : 2Cl- Cl2 + 2e.
Hanya ada gas di anoda yaitu gas Cl2.
2. Larutan AgNO3 pada elektroda innert.
Katoda : Ag+ + 2 e -> Ag
Anoda : 2H2O 4H+ + O2 + 4e.
Di katoda terbentuk logam Ag, di anoda gas O2
3. Larutan CuSO4 dengan elektroda innert.
Katoda : 2H2O + 2e 2OH- + H2
Anoda : 2H2O 4H+ + O2 + 4e
Di katoda gas H2, di anoda gas O2
4. Larutan CuSO4 dengan elektroda Cu.
Katoda : Cu2+ + 2e Cu
Anoda : Cu Cu2+ + 4e
5. Larutan KNO3 pada elektroda innert.
Katoda : 2H2O + 2e 2OH- + H2
Anoda : 2H2O 4H+ + O2 + 4e
Di katoda terbentuk gas H2, di anoda gas O2
Jadi peristiwa elektrolisasi terjadi pada gambar 3 dan 5
43. 50 ml larutan Ba(OH)2 0,1 M diperlukan untuk menetralisir hasil elektrolisis LSO4 dengan elektroda Pt. Jika di katode terbentuk 0,325 gram logam L, maka massa atom relatif logam tersebut adalah ….
A. 24 B. 40 C. 56 D. 59 E. 65
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 2003
Penyelesaian :
Katoda : 2L2+ + 4 e 2L
Anoda : 2H2O 4H+ + O2 + 4 e.
2L2+ + 2H2O 2L + 4H+ + O2
(H+) dapat dinetralkan oleh 50 ml larutan Ba(OH)2 0,1M.
Berarti (H+) = (OH-).
(OH-) = = 10-2 mol = (H+)
mol L= x 10-2 = 5 x 10-3 mol.
5 x 10-3 mol = 0,325 gram.
1 mol = = 65 gram






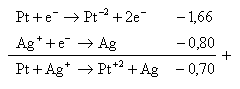
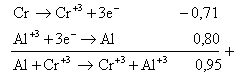
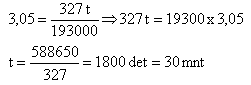













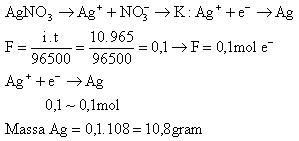

87 Komentar untuk "Soal dan Pembahasan Elektrolisis dan Elektrokimia"
kak, boleh minta file ini gak? ini email saya nuruldesyanarahman@gmail.com. terima kasiih :)
Tolong kirim file ini ke juwita.citrus@gmail.com, Thanks. Btw, kenapa yg nomor 5 gak litium?? kan Li disebelah kiri Fe juga.,
karena lithium sangat reaktif :)
blh minta file ini? email saya pro_fezort@yahoo.com, mtrswn...
silviaveronica999@gmail.com
silviaveronica999@gmail.com
kak boleh minta filenya,tolong kirimkan ke email saya rizkilah24willy@gmail.com mkasih kak
tolong dikirimkan filenya ke ca.yenikhomaria@gmail.com
Kak,,, boleh minta filenya?,, kalo boleh tolong kirim ke email saya
syahidane123@gmail.com . terima kasih
Kak,, apa saya boleh minta file ini?
Kalau boleh, minta tolong kirim ke email theresiaditaputri@gmail.com
terima kasih
assalamualaikum.wr.wb
selamat pagi kak.
apa saya bias minta soalnya kah kak, kalau boleh minta ta kirimkan ke email saya kak muhamadsuwandi13@gmail.com
siang kak...boleh minta soalnya? tolong dikirim ke email saya suzan16671@gmail.com...terima kasih
sangat bermanfaat, mohon izin download, makasih
agusgaruttea@gmail.com
bisa tolong kirim ke pinastiputr@gmail.com , terimakasih :)
rahmadanisonya@gmail.com
Thank you!
shaltsanadya@yahoo.com
please ya kak, terimkasih ^-^
mohon izin download
izin download
izin download
kak boleh minta file ini nggak? email saya vecynthia.cs@gmail.com
Terimakasih sebelumnya kak
kak boleh minta file artikel ini? tolong ya kak..
email : ninikns559@gmail.com
terima kasih ya kak sebelumnya..
boleh minta filenya gak kak ? kirim ke ardhentasigitp@gmail.com
terimakasih
boleh minta filenya gak kak ? kirim ke ardhentasigitp@gmail.com
terimakasih
graciaeunike@gmail.com
kak boleh minta filenya??
biikonjjang@gmail.com
makasih sebelumnya...
galihfatoni98@gmail.com
waklengpakciksisir@gmail.com
delvissmkmutu@gmail.com
d765776@gmail.com
suciangraini11@icloud.com
dimaalfiansyah@gmail.com
kak soal-soalnya sangat membantu, boleh minta filenya dong kak ke dimaalfiansyah@gmail.com
Tolong kirim ke email ini yaa
krishnayana1999@gmail.com
Terima kasih banyak sangat membantu
minta file nya dong, kirim ke fherllyzzputra@gmail.com ya
cara downloadnya gmn?
Kak boleh minta file ini. Kirim di email ini annisaayu63@gmail.com yaa. Terima kasih
Kak bisa kirim di email saya kak amrzaki111099@gmail.com
Minta soalnya dong
Sahrulflava@gmail.com
kak, mau filenya dong.. butuh banget buat belajar kimia redoks :)) kirim ke ninikns559@gmail.com ya kak
boleh minta file nya nggak kak? kirim ke hakmakurnialestari6@gmail.com makasih kak
Boleh minta filenya kak? Kirim ke newasynau.1208@gmail.com terima kasih
muhammadifhalkosasih@gmail.com
ofan_naufal@yahoo.com
izin download filenya ka
kak minta ya filenya alfanprasetyoo@gmail.com
kak minta filenya ya kak salmafikri920@gmail.com
kak, saya mau kak katyushayoung@gmail.com
kak, saya mau kak katyushayoung@gmail.com
bisa minta filenya..?
izin download filenya ka robbyfarhan.22@gmail.com
permisi,om..mau minta tolong untuk download filenya, om....
fredwan7@gmail.com
terima kasih sebelumnya..semoga semakin bermanfaat..
Permisi kak, boleh minta soal2 tersebut (soal dan pembahasan elektrokimia dan elektrolisis)
minta tolong kirim ke email saya ya
erindwiagusherlina8@gmail.com
terima kasih
Kak, boleh tolong kirimkan file soal-soal nya ke email saya kamilasalsa21@gmail.com
Sebelumnya terimakasih kak
kristinaelpita@gmail.com
maaf, kalau boleh saya minta file untuk bahan referensi. terima kasih
wassallam
Soal soal dan pembahasannya sangat lengkap dan bagus. mohon dikirim filenya ke email saya ya...Trimakasih
purnomowati66@yahoo.co.id
oliviatheway@gmail.com
aawala38@gmail.com
shilfiafajri@gmail.com
neviritykirana01@gmail.com
kak,boleh minta file ini ? Mohon kirimkan ke roslainileni@yahoo.o.id
Kak, ijin minta filenya kak.. hehe
Email saya haniimtihanah98@gmail.com
Terima kasih kak
boleh dikirim filenya email:haeruddinsaleng@yahoo.co.id
terima kasih
siang kak, minta file soalnya boleh? kirim ke urfuture.nutritionist@gmail.com , terimakasih sebelumnya, semoga ilmu yg dibagikan menjadi berkah aminn.
Boleh minta file nya ke niadamayanti494@gmail.com
Boleh minta filenya ke ryan.nightreaper@gmail.com
boleh minta file ini kak? email saya ega.yodela@gmail.com
judit.pcy2713@gmail.com
yuni.hidayani17@gmail.com
laluagumwg12@gmail.com
Krim ke email saya dong kak athiellaapriyanti@gmail.com
Kak kirimin asnaalana2@gmail.com
aisyahbsj02@gmail.com
kak boleh minta tolong minta filenya ke email adnanidifa8@gmail.com
sundaretno94@gmail.com
kak mau fong
giovanonesta006@gmail.com
kak boleh minta file artikelnya?
reqita.wijaya.a2731@gmail.com
🙏
@kadekyunyun02@gmail.com
hai kak, boleh minta filenya, minta tolong dikirim ke rifkyahmad257@gmail.com terima kasih banyak 🙏🏻
athakhanza1704@gmail.com
Hai kak, boleh minta file nya kak butuh banget buat belajar, tolong dikirim ke alifiazelikaam@gmail.com terimakasih banyak kak sebelumnya
Assalamu'alaikum kak, jika kakak berkenan boleh minta file ini, ini alamat emailnya kak zizahnur07@gmail.com
Terima kasih :)
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)