1. Tagog Apu [23 poin]
a. Tuliskan reaksi kimia setara pada pemanasan dolomite. [2]
MgCa(CO3)2 MgO(s) + CaO(s) + 2CO2(g) [2]
b. Tentukan rumus kimia lansfordit. [5]
Gas CO2 sebanyak 5,85 L setara dengan 0,261 mol [1] Mr lansfordit = 45,5:0,261 = 174,3 [2]
Rumus kimia lansfordit = MgCO3 5H2O. [2]
c. Tuliskan persamaan pelarutan dolomit, dan tuliskan ungkapan Ksp-nya. [4]
MgCa(CO3)2 (s) + H2O Mg2 + Ca2 + 2CO3 2
Ksp = [Mg2] [Ca2] [CO3 2]2 [2]
d. Tuliskan reaksi asam basa ion karbonat dan H+. [2]
H + CO3 2 HCO3
e. Apa akibat dari hujan asam pada kelarutan dolomit di pegunungan kapur? Tuliskanlah reaksinya. [3]
Gunung kapur akan terkikis (larut dalam air yang bersifat asam) [1]
MgCa(CO3)2 + H+ Mg2 + Ca2 + H2CO3 (CO2 + H2O) [2]
f. Gambarkan struktur Lewis (termasuk struktur resonansinya) dan perkirakan bentuk geometri ion karbonat. [5] Gambar [3]
Segitiga datar [2]
g. Jelaskan dampak pemanasan dolomit terhadap iklim di muka bumi? [2]
Pemanasan dolomit dapat meningkatkan konsentrasi CO2(gas rumah kaca/ green house gas) di atmosfir yang mengakibatkan pemanasan global. [2]
2. Rumus kimia Garam sulf at [22 poin]
a. Tuliskan persamaan reaksi larutan garam sulfat dengan barium klorida berlebih dan hitung %
massa sulfat dalam sampel tersebut [3]
|
BaSO4 [1]
% massa sulfat = 96*0,2329*100/(233*0,1471) = 65,23% [2]
b. Atas dasar % massa sulfat yang diperoleh, hitung massa molekul garam sulfat menurut
masing-masing siswa tersebut | [6] | |
Massa molekul garam sulfat menurut siswa-1 =100*96*2/65,23 =294 Massa molekul garam sulfat menurut siswa-2 = 100*96/65,23 = 147 Massa molekul garam sulfat menurut siswa-3 = 100*96*3/65,23 = 441 | [2] [2] [2] |
c. Tuliskan rumus kimia garam yang diperoleh masing-masing siswa tersebut dan buktikan dengan perhitungan yang mendukung temuan mereka masing-masing. [9] Rumus kimia menurut siswa-1: Ti(SO4)2 3H2O [294-240 =54 setara dengan 3H2O] [3]
Rumus kimia menurut siswa-2: NaSO4 0,3H2O [147-119 = 28 setara dengan 1,5H2O] [3]
Rumus kimia menurut siswa-3: Al2(SO4)3 5,5H2O [441-342 = 99 setara dengan 5,5 H2O] [3]
d. Sarankan minimal dua uji lanjutan yang harus dilakukan untuk membuktikan kebenaran jawaban siswa tsb? [4] Reaksi pemanasan diatas 100oC untuk mengetahui jumlah air hidrat [2]
Pengukuran hantaran ion dengan konduktometer [2]
3. Hidrogen Radioaktif [23 poin]
a. Lengkapi reaksi inti yang menghasilkan tritium [2]
b. Tuliskan reaksi inti untuk peluruhan tritium. [2]
c. Hitunglah energi yang dilepaskan pada peluruhan 1 mol tritium (massa
= 3,0160492 sma,
dan massa
= 3,0160293 sma). [4]
[2]
47616766668,9 J/mol = 47616766,6689 kJ/mol = 4,761 x 107 kJ/mol [2]
d. Hitung jumlah mol T2O yang terdapat dalam 1 L air minum yang mempunyai radioaktivitas
10000 Bq. Anggaplah bahwa hanya T2O yang menjadi sumber radiasi dalam air tersebut.
[1]
e. Hitunglah berapa lama (dalam tahun) manusia akan dapat melihat cahaya atau foton yang dipancarkan oleh arloji yang diisi 7x1012 molekul gas tritium (T2). [4]
Manusia mampu melihat sinar bila 70 foton diemisikan setiap detiknya. Ini berarti bahwa
140 disintegrasi tritium per detiknya. (Material ber-fluorosensi memancarkan satu photon per 2 elektron).
[2]
f. Turunkan persamaan laju untuk reaksi 2O33O2 berdasarkan mekanisme reaksi di atas. [4]
[1]
g. Bila persamaan kinetika untuk reaksi 2O3 3O2 menjadi , bagaimana pernyataan
untuk tetapan k? [3]
[1]
Bila konsentrasi ozone sangat rendah:
Maka persamaan kinetika dapat disederhanakan menjadi :
4. Reaksi Fischer-Tropsch [32 poin]
a. Hitung fraksi mol gas hidrogen di dalam silinder sebelum reaksi. [2]
XH2 = PH2 / Ptotal = 30 atm/40 atm = 0,75 [2]
b. Tuliskan reaksi yang setara antara gas CO dan H2 yang menghasilkan (i) metana, (ii) etena dan (iii) propena. [6]
(i) CO + 3H2 CH4 + H2O [2] (ii) 2CO + 4H2 C2H4 + 2H2O [2]
(iii) 3CO + 6H2 C3H6 + 3H2O [2]
c. HitungH untuk masing-masing reaksi yang Anda tuliskan pada jawaban (a). (Pada 400 K, air yang terbentuk masih dalam fasa gas). [6]
Hi = Hfo CH4 +Hfo H2O - Hfo CO = -74,9 – 241,8 – (-110,5) = -206,2 kJ [2]
Hii = Hfo C2H4 +×Hfo H2O - 2×Hfo CO = 52,3 + (-241,8 x 2)– (-110,5x2) = -210,3 kJ [2]
Hiii = Hfo C3H6 +×Hfo H2O - 3×Hfo CO = 20,6 + (-241,8 x 3)– (-110,5x3) = -373,3 kJ [2]
d. Gunakan data hasil reaksi di atas untuk menghitung banyaknya (dalam mol) metana, etena dan propena yang dihasilkan pada reaksi Fischer-Tropsch tersebut. Asumsikan semua gas bersifat ideal dan R = 0,082 L atm mol1 K1. [12]
Andaikan nCH4 = x, n C2H4 = y dan n C3H6 = z. Untuk memperoleh nilai x, y dan z diperlukan 3 persamaan yang mengkaitkan ketiga variable tersebut: 1 pers dari mol air yang dihasilkan, 1 pers dari kalor yang dihasilkan dan 1 pers dari tekanan setelah reaksi.
mol air = 44,74/18 = x + 2y + 3z
2.49 = x + 2y + 3z (1) [2]

399.16 = 206.2 x + 210.3 y + 373.3 z (2) [2] V P2 = n2 RT2 n2 = V P2/RT2
n2 = nCO + nH2 + nCH4 + nC2H4 + nC3H6 nCO = nCO awal – nCO bereaksi
= (10x10)/(0.082x400) – (x+2y+3z)
= 3.05 – x – 2y – 3z [1]
n2 = nCO + nH2 + nCH4 + nC2H4 + nC3H6
nH2 = nH2 awal – nH2 bereaksi
= (30x10)/(0.082x400) – (3x+4y+6z)
= 9.15 –3 x – 4y – 6z [1]
= (3.05 – x – 2y – 3z) + (9.15 –3 x – 4y – 6z) + x + y + z
= 12.20 – 3x – 5y – 8z [2]

3x + 5y + 8z = 6.96 (3) [2]
Penyelesaian pers. (1), (2) dan (3) memberikan nilai x =1,21 , y=0,251 dan z=0,259 . Sehingga jumlah mol metana, etena dan propena yang terbentuk masing-masing adalah 1,21 mol,
0,251 mol dan 0,259 mol. [2]
e. Hitung tekanan parsial gas hidrogen di dalam silinder setelah reaksi pada 298 K. [3]
PH2 = nH2 R T/V = (9.15 – 3x – 4y – 6z) (0.082 x 298)/10 [2]
= (9.15 – 3×1.21 - 4×0.251 - 6×0.259) ×0.082× 298/10 = 7,238 atm. [1]
f. Jika ret adalah laju reaksi pembentukan etena dan rpr adalah laju reaksi pembentukan propena dalam reaksi tersebut, hitung nilai ret / rpr. [3]
Karena volume wadah dan waktu reaksi (t) untuk produk etena dan propena sama, maka ratio kecepatannya dapat dihitung sebagai berikut.
[3]
5. Kompleks Mn(III) yang unik [25 poin]
a. Tuliskan konfigurasi elektron terluar pada ion Mn(III) dan hitung berapa elektron yang tidak berpasangan pada ion Mn(III). [2]
Konfigurasi elektron Mn(III) = [Ar]d4 ada 4 elektron tidak berpasangan [2]
b. Hitung energi penstabilan medan kristal (CFSE) pada senyawa CsMn(SO4)2 12 H2O dan
K3[Mn(CN)6], nyatakan dalam energi pembelahan | orbital | () | dan | energi | untuk |
memasangkan elektron (P). | [4] | ||||
senyawa CsMn(SO4)2 12 H2O = (3*0,4) +0,6 = 0,6 senyawa K3[Mn(CN)6]= 1,6+P | [2] [2] |
c. Tuliskan persamaan reaksi pembentukan ligan Salen-H2 dan lengkapi dengan gambar struktur semua senyawa tersebut. [7]
2 hidroksi benzaldehyde +1,2-diaminoetana N,N′-Bis(salicylidene)ethylenediamine [1] Gambar [6]
d. Tuliskan rumus kimia kompleks kationik bermuatan +1, kompleks anionik bermuatan -1 dan kompleks non-ionik yang mungkin terbentuk. Gambarkan pula sketsa struktur ketiga kompleks tersebut [6]
Kationik [Mn(salen)(H2O)2] [2]
Anionik [Mn(Salen)Cl2]
Non-ionik [Mn(salen)Cl(H2O)]
e. Tuliskan kedua tahap reaksi dismutase radikal anion superoksida [6]
|
Mn2
+ O2 [3]
Mn2 + 2H + O2 Mn
+ H2O2 [3]
6. Pengaruh pH dan Penambahan Ligan pada Potensial Reduksi
Standar [19 poin]
a. Hitunglah potensial reduksi standar, E°3 dari Fe3+ + e Fe2+ dengan menggunakan hukum
Hess untuk perubahan energi bebas Gibss, Go, dari setengah reaksi Fe2+|Fe dan Fe3+|Fe
[4]
reaksi | Potensial | Go= -nFEo |
Fe3++ 3e Fe | E°2 = -0,036V | -3xFx(-0,036) =0,108 F |
Fe2+ + 2e Fe | E°1 = -0,440 V | -2x Fx (-0,440)=0,880 F |
Fe+3+e Fe+2 | E°3 = ? | =-0,772 F |
Eo = -0,772F/1x F = 0,772 V
E°3 = (3 E°2 – 2 E°1) = 0,772 V (dihitung menggunakan diagram Latimer)
|
|
|
= Go
- Go
[1]
-nFEo3 = -nFEo2 –(-nFEo1) [2]
-FEo3 = -3FEo2 – (-2FEo1)
|
|
|
= 3Eo
– (2Eo ) = 3(-0,036) – (2(-0,440)) = -0,108 – (-0,88) = 0,772 V [1]
b. Hitunglah rasio tetapan pembentukan kompleks, Kf, [Fe(CN)6]3 terhadap Kf [Fe(CN)6]4 [5]
a. Reaksi: [2]
|
|
|
|
Kf1 Go
|
|
|
Hukum Hess: [3]
|
|
|
= Go
+ Go
- Go
-nFEo4 = -RTlnKf2 – nFEo3 –(-RTlnKf1)
-nF(Eo4 – Eo3) = -RT(lnKf2 - lnKf1) Eo4 – Eo3 = RT/nF ln(Kf2/Kf1)
(0,356 – 0,772) = (8,314 x 298)/(1 x 96500) ln(Kf2/Kf1)
- 0,416 = 0,02567 ln(Kf2/Kf1)
ln(Kf2/Kf1) = - 0,06171
Kf2/Kf1 = 9,16 x 10-8 atau Kf1/Kf2 = 1,09 x 107
Atau cara lain:
3-
6 (FeIII) = [Fe(CN)6
|
] / ([Fe
] / ([Fe2+
].[CN ] ) [1]
].[CN-]6) [1]
E°4 = E°3 + 0,059 log (6 (FeII) / 6 (FeIII) [2]
(6 (FeII) / 6 (FeIII) = 10-7,05 = 8,90x10-8 atau (6 (FeIII) / 6 (FeII) = 1,12 x 107 [1] Catatan: nilai Kf2/Kf1 ~ 9 x 10 atau Kf1/Kf2 ~ 1 x 10

Reaksi: [2]
H3AsO4 + 2H+ + 2e H3AsO3 + H2O x1 Eo5
|
Fe(CN) 3-
+ e x2 Eo4
|
H3AsO4 + 2H+ + 2 Fe(CN)6
H3AsO3 + H2O + 2Fe(CN)6
Awal a 2a - - Reaksi -x -2x x 2x Setimbang a – x 10-2 2a – 2x x 2x
3- 2
4- 2 + 2
E = Eo – 0,059/2 log ([H3AsO3] [Fe(CN)6
] /([H3AsO4][Fe(CN)6
] [H ] ) [2]
Pada kesetimbangan E = 0; pH = 2,00 [H+] = 10-2
3- 2
4- 2 + 2
Eo = 0,059/2 log ([H3AsO3] /([H3AsO4] x ([Fe(CN)6 ]
/[Fe(CN)6 ])
x 1/ [H ] )
(Eo5 – Eo4) = 0,059/2 log ((x)/(a-x) . ((2x)/(2a-2x))2 . 1/10-4)) (0,560 – 0,356) = 0,059/2 log ((x/(a-x)) . (2x/2(a-x))2 . 1/10-4))
0,204 = 0,0295 log ((x/(a-x))3 . 1/10-4) = 0,0295 (log (x/(a-x))3 + log 104)
0,204/0,0295 = 3 log (x/(a-x)) + 4
6,915 – 4 = 3 log (x/(a-x))
2,915/3 = log (x/(a-x))
0,9717 = log (x/(a-x))
x/(a-x) = 9,370
x = [H3AsO3]; (a-x) = [H3AsO4];
maka rasio [H3AsO4]/[H3AsO3] pada kesetimbangan = (a-x)/x = 1/9,370 = 0,107 [1] Atau cara lain:
Reaksi: H3AsO4 + 2H+ + 2e H3AsO3 + H2O x1 Eo5 [2]
|
Fe(CN) 3-
+ e x2 Eo4
|
H3AsO4 + 2H+ + 2 Fe(CN)6
H3AsO3 + H2O + 2Fe(CN)6
Awal a 2a - - Reaksi -x -2x x 2x Setimbang a – x 10-2 2a – 2x x 2x
pH = 2,00 [H+] = 10-2
3- 2
4- 2 + 2 2
2 -2 2
K = [H3AsO3] [Fe(CN)6
] /([H3AsO4][Fe(CN)6
] [H ]
= (x)(2x) /(a-x)(2a-2x) (10 )
K = (x)(2x)2/(a-x)(2(a-x))2(10-2)2 = 4x3/4(a-x)3(10-2)2 = x3/(a-x)3 . 104
Pada kesetimbangan: Go = -RTlnK = -nFEo;
maka lnK = nFEo/RT = 2(96500)(Eo -Eo )/8,314(298) = 2(96500)(0,204)/ 8,314(298) =
5 4
15,89
sehingga K = 7,97 x 106
K = 7,97 x 106 = x3/(a-x)3 . 104
7,97 x 106/104= x3/(a-x)3
797,135 = x3/(a-x)3; maka x/(a-x) = (797,135)1/3 = 9,272 x = [H3AsO3]; (a-x) = [H3AsO4];
maka rasio [H3AsO4]/[H3AsO3] pada kesetimbangan = (a-x)/x = 1/9,272 = 0,107 [3] Atau cara lain:
E = (n5E5°′ + n6E6°′) / n5 + n6 [1]

E5°′ = E5° + (0,059/2) log [H3O+]2 = E5° - 0,059 pH = 0,442 V [2] E = (2x0,442 + 0,356)/3 = 0,413 V
0,413 = 0,442 + 0,059/2 log([H3AsO4]/[H3AsO3])
[H3AsO4]/[H3AsO3] = 0,107 [2]
|
dan Idengan konsentrasi

Reaksi: [2]
H3AsO4 + 2H+ + 2e H3AsO3 + H2O x1 Eo5
|
+ 2e x1 Eo6
H3AsO4 + 2H+ + 3I H3AsO3 + H2O + I3
- + 2 - 3
E = Eo – RT/nF ln [H3AsO3] [I3 ] /[H3AsO4][H ] [I ]
- -
[2]
Pada kesetimbangan E = 0; [H3AsO4] = [H3AsO3] = [I3 ] = [I ] = 0,100 M
- - 3 + 2
Eo = 0,059/2 log ([H3AsO3] [I3 ] /[H3AsO4] [I ]
[H ] )
(Eo5 – Eo6) = 0,0295 log ((0,100)(0,100)/(0,100)(0,100)3 . [H+]2) (0,560 – 0,540) = 0,0295 log (10-2/10-4. [H+]2)
0,02 = 0,0295 (log 102 – log [H+]2) = 0,0295 (2 – 2 log [H+]) = 0,059 - 0,059 log [H+] =
0,059 (1 + pH)
pH = (0,02 – 0,059)/0,059 = - 0,66 [1]
Atau cara lain:
- - 3
E6 = E°6 + 0,059/2 log ([I3 ]/[I ] ) = 0,540 + (0,059/2)x2 = 0,599 V [3]
E5 = 0,599 V = 0,560 – 0,059 pH
pH = -0,66. [2]
7. Kandungan Senyawa dalam “Surawung” [31 poin]
a. Gambarkan struktur produk hidrolisis asam rosmarinat dalam suasana asam. [6]
b. Tuliskan reagen pereduksi yang sesuai untuk mereduksi gugus karboksilat menjadi gugus hidroksil dalam struktur asam litospermat dan gambarkan struktur produk tereduksinya tersebut. [4]


c.
i. Urutkan kereaktifan senyawa terhadap reaksi tersebut mulai dari yang paling reaktif dan jelaskan! [3]
Urutan kereaktifan: asam ferulat > asam p-kumarat > asam sinamat. (1 poin)

ii. Jika ketiga senyawa tersebut direaksikan dengan Br2 dalam kondisi adanya FeBr3, gambarkan struktur produk yang terbentuk. [6]
Masing-masing struktur produk 2 poin
d. Tuliskan skema reaksi beserta reagen dan kondisi yang menunjukkan pengubahan asam sinamat menjadi asam 3-fenilpropanoat! [3]
Reagen dan kondisi: 1 poin Struktrur produk: 1 poin Skema reaksi: 1 poin
e. Gambarkan struktur produk X, Y dan Z dalam setiap tahap reaksi berikut. [9]

8. Tahu, Tempe dan Isoflavon [27 poin]
a. Gambarkan struktur senyawa A dan B pada skema sintesis senyawa turunan isoflavon [6]
Masing-masing struktur 3 poin
b. Gambarkan struktur produk yang terbentuk apabila genistein direaksikan dengan etil 4- bromobutirat dalam suasana basa (t-BuOK = kalium tertier-butoksida). [3]
c. Gambarkan struktur produk yang terbentuk apabila daidzein direaksikan dengan penta-O- asetil--glukopiranosa dalam suasana basa. [3]
d. Gambarkan mekanisme reaksi antara 17-estradiol dengan senyawa benzoil klorida dan gambarkan produk yang terbentuk. [6]
Mekanisme reaksi: 3 poin; struktur: 3 poin
e. Gambarkan struktur senyawa K, L dan M dalam skema salah satu usulan reaksi untuk sintesis 17-estradiol di laboratorium. [9]




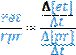





























0 Komentar untuk "Soal dan Pembahsan OSN KIMIA Tahun 2013"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)