Apabila kita mencampurkan suatu zat (solut) ke dalam air lalu diaduk, akan terbentuk keadaan
berikut :
- Terbentuk campuran homogen (serba sama pada setiap bagian) disebut larutan;bentuk partikel solut dalam larutan dapat berupa molekul (misalnya gula) atau ion( misalnya Na+ dan Cl- dari NaCl).
- Terbentuk campuran yang tidak jernih , tapi tidak tejadi endapan Solut seolah-olah terbagi dalam pelarut, tetapi bersifat heterogen; misalnya mencampurkan amilum dengan air panas (membentuk kanji)
- Terbentuk campuran yang dengan segera mengedap, sehingga terlihat dua lapisan (heterogen) ; solut di bagian bawah dan pelarut di bagian atas.; misalnya mencampurkan pasir dengan air.
Keadaan (1) disebut larutan , (2) disebut sistem koloid ( = koloid) dan (3) disebut suspensi . Ketiga jenis campuran tersebut terutama disebabkan oleh juga berbeda oleh ukuran partikel solutnya, yaitu : (1) larutan : 1 – 10 A0 ; (2) koloid : 10 – 10.000 Ao, sedangkan (3) suspensi : > 10.000 Ao
Sehingga koloid (sistem koloid ) didefinisikan sebagai : campuran heterogen antara solut dengan pelarut, di mana solut tetap berada (tersebar) pada pelarut.
Dalam sistem koloid terdapat dua bagian fasa, yaitu : (1) fasa dalam, disebut juga fasa terdispersi ; yaitu solut dan (2) fasa luar , disebut juga fasa pendispersi , yaitu pelarut . Pada contoh “larutan” kanji maka amilum adalah fasa terdispersi (fasa dalam) sedangkan airnya adalah fasa pendispersi (fasa luar)
Jenis Koloid
Karena baik solut maupun pelarut mempunyai tiga macam fase; yaitu gas, cair dan padat maka terdapat 8 macam sistem koloid (sebab campuran gas debfab gas akan membentuk sistem homogen ) seperti pada tabel berikut
| Fasa Terdispersi | Fasa Pendispersi | Penyebutan | Nama | Contoh |
| Gas Gas Cair Cair Cair Padat Padat padat | Cair Padat Gas Cair Padat Gas Cair padat | Gas dalam cair Gas dalam padat Cair dalam gas Cair dalam cair Cair dalm padat Padat dalam gas Padat dalam cair Padat dlm padat
| Buih Busa padat Aerosol cair Emulsi Emulsi padat Aerosol pdt Sol Sol padat | Busa sabun Karet busa Kabut Susu Mentega Asap Lart kanji Camp logam ( perunggu ) |
Sifat-sifat Koloid.
1. Efek Tyndall ; partikel-partikel solut dalam koloid menyerap sinar yang mengenainya, sehingga partikel-partikel tsb terlihat oleh mata kita (sedangkan larutan meneruskan sinar yang mengenainya) . Lihat gambar berikut
2. Gerak Brown ; adalah gerakan partikel koloid ke segala arah secara.Gerakan ini disebabkan oleh tumbukan antara partikel-partikel solut dengan molekul-molekul pelarut .
Kestabilan Koloid
Sistem koloid dapat tetap stabil (tidak mengendap) karena partikel-partikel koloid tidak berkelompok ( bergabung sesamanya ) menjadi partikel yang lebih besar yang memungkinkan untuk mengendap .
Kestabilan koloid dapat disebabkan oleh dua hal, yaitu :
(1) partikel koloid menyerap ion-ion yang berada dalam mediumnya , sehingga seolah-olah
“dilindungi” untuk tidak bergabung sesamanya . Keadaan ini terutama terjadi pada koloid
senyawa anorganik .
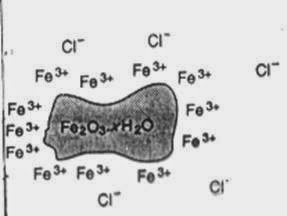
Contoh ; apabila kita masukkan larutan FeCl3 ke dalam air, akan terbentuk sol
Fe2O3 . x H2O yang menyerap ion-ion Fe3+ di lapisan dalam (lapisan I) dan ino-ion Cl- sebagai
lapisan luar (lapisan II).
(2) adanya emulgator; yaitu zat yang ketiga yang melindungi patikel koloid agar tidak bergabung
sesamanya; misalnya minyak yang “dilindungi “ oleh sabun . Contoh beberap zat yang dapat
berfungsi sebagai emulgator ialah sabun dan deterjen.
Pengendapan koloid
Partikel-partikel solut dalam sistem koloid dapat bergabung sesamanya apabila ion-ion yang diserap pada permukaan koloid dihilangkan dengan jalan menambahkan elektrolit ( asam, basa atau senyawa garam ) , sehingga terjadi penggumpalan lalu mengendap (koagulasi) . Misalnya apabila kita menambahkan asam ke dalam susu akan terjadi penggumpalan pada bagian permukaan susu tsb. Proses penjernihan air sumur keruh atau air sumber PDAM yang keruh adanya lumpur dan ion-on Ca2+ dan Mg2+ (air sadah) ,dilakukan dengan penambahan tawas , KAl(SO4)2 karena akan terbentuk endapan CaSO4
Proses lain yang dapat menyebabkan pengedpan oloid adalah peristiwa pergeseran pelarut ; yaitu “penarikan “ pelarut oleh pelarut lain yang dapat campur dengan pelarut semula. Misalnya suatu senyawa organik antibiotik yang mengendap dalam air, tetapi dapat tersuspensi dalam alkohol; apabila ke dalam suspensi alkaloid tersebut ditambahkan air akan terjadi pengumpalan solut alkaloid, karena alkohol bercampaur (“ditarik”) oleh air sehingga alkohol yang melarutkan alkaloid berkurang dan terjadi penggumpalan alkaloid.
Macam Koloid Berdasarkan Interksinya dengan Pelarut ( Air )
1. Koloid Hidrofil ; yaitu koloid yang dapat campur dengan air , dapat diencerkan dan lebih stabil . Contohnya klid dari senyawa-senyawa organik, misalnya kanji (amilum), agar-agar, dsb
2. Koloid Hidrofob ; kebalikan dari koloid hidrofil, yaitu tidak campur dengan air, sehingga tidak dapat diencerkan dan kurang stabil. Contoh : Kebanyakan koloid dari senyawa anorganik, misalnya sol belerang ( S ) , Fe(OH)3 , dsb
Cara-cara Pembentukan Koloid
Sistem koloid terutama ditentukan ukuran partikel solut, makin kecil ukuran partikel solut,makin mudah larut ( membentuk larutan “ sejati “ , dan sebaliknya, makin besar ukuran partikel solut, akan mudah membentuk endapan.
Oleh karena itu pembentukan koloid ada dua macam :
1. Cara Dispersi;
Yaitu dengan cara memperkecil ukran partikel solut ( misalnya digerus / digiling.
Contoh: susu bubuk ( protein ) dibuat bentuk “ instant “ ( agar mudah / cepat campur / larut )
. Pada cara ini hanya terjadi perubahan fisik ( sifat fisik )
2. Cara Kondensasi
Cara kondensasi berkebalikan dengan cara dispersi, yaitu memperbesar ukuran partikel ( dari bentuk larutan sejati menjadi bentuk koloid ) . Pada cara ini terjadi perubahan kimia
Contoh : a) Proses hidrolisisi FeCl3 (aq) + H2O ® Fe(OH)3 (s) + 3 HCl ( aq )
b) Proses redoks : K2S2O3 + HCl ® S (s) + KCl + H2O + SO2 (g)
Pemurnian Koloid
Ialah proses penghilangan ion-ion pada permukaan partikel koloid, dengan cara :
1) dialiri pelarut
2) diserap ( dialisis ) ( pada proses “ cuci darah “ pada pederita gagal ginjal; yaitu penghilangan ion-ion
amonia ( NH4+ ) dari permukaan betir-butir darah oleh zat penyerap )
Beberpa contoh sistem koloid yang penting
1. Sol – Gel
Gel ialah koloid hidrofil yang kental dan jika ditambah pelarut ( air ) berubah menjadil koloid yang
encer, disebut sol . Sebaliknya bentok sol dapat diubah menjadi gel jika pelarutnya ( air ) dikurangi ,
misalnya dengan cara penguapan dengan pemanasan . Dengan demikian bentok koloid sl – gel
bersifat reversibel ( dapat diencerkan atau dikentalkan .Contohnya “ larutan “ amilum atau kanji
2. Emulsi
Emulsi ialah campuran cair – cair ( misalnya minyak dengan air ) . Pada bentuk emulsi penambahan
salah satu cairan ( air atau minyak ) bukan proses pengenceran. Terdpat dua jenis emulsi , yaitu :
(1 ) emulsi sistem minyak dalam air ( O / W ) = oil in water ; misalnya : santan
(2) emulsi sistem air dalam minyak ( W / O ) = water in oil ; misalnya sediaan kapsul vit. D


![clip_image002[5] clip_image002[5]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgNCFQCSMsYPp3FRqBamFvBqrXrZxTsEYJUJjpvmezHMPeFp5aC-Xa4gOtSkFZTs3klf-uUxzktTxk1-Z3Yg0muagpqOPe92YtAj441udSUkFSSrLW0jF3-1zukZaiGeYqB-KSpHGBLAzA/?imgmax=800)




0 Komentar untuk "Mengenal lebih jauh Koloid"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)