Garam yang terbentuk dari hasil netralisasi asam basa dapat memberikan nilai pH yang beragam tergantung ion asal pembentuk garamnya, contoh:
Tabel 8.1. Kelompok garam dan nilai pH
| Garam yang berasal dari | Contoh | pH larutannya |
| Asam kuat dan basa kuat | NaCl, KNO3, Na2SO4 | 7 |
| Asam lemah dan basa kuat | NaCH3COO, KCN, Na3PO4 | > 7 |
| Asam kuat dan basa lemah | NH4Cl, NH4NO3, (NH4)2SO4 | < 7 |
| Asam lemah dan basa lemah | (NH4)2CO3, NH4CH3COO, NH4CN | Berbeda-beda |
Kenapa pH garam berbeda-beda? Bukankah seharusnya garam akan membentuk larutan netral dengan pH 7? Hal ini terjadi akibat adanya interaksi antara kation dan anion dari garam dengan air sebagai pelarut. Reaksi antara kation dan anion dengan air yang menyebabkan air terurai disebut dengan hidrolisis. Kation yang mengalami hidrolisis adalah kation yang berasal dari basa lemah, contoh;
sedangkan anion yang terhidrolisis adalah anion yang berasal dari asam lemah.
Garam yang berasal dari asam kuat dan basa kuat tidak terhidrolisis sehingga pH larutannya 7. Jika akibat hidrolisis pH berubah, bagaimana cara menentukan pH larutan garam yang terhidrolisis? Untuk garam yang berasal dari asam lemah, asam lemah akan mengalami kesetimbangan:
Tetapan kesetimbangan untuk reaksi tersebut :
karena [H2O] harganya relatif tetap, maka
K [H2O], disebut dengan tetapan hidrolisis dan dilambangkan dengan
dengan mengalikan dengan factor [H+], maka ;
kembali pada
mulai : a M 0 M 0 M
perubahan : -x x x
kesetimbangan : a – x x x
karena asam lemah terdisosiasi dalam jumlah sangat sedikit, maka
[A-] = a - x = a, dan [OH- ] = [HA] = x
karena ;
pOH = 7 - ½ log [A-] + ½ log Ka
dengan cara yang sama untuk hidrolisis garam dari basa lemah, kita memperoleh :
pH = 7 - ½ log [B-] + ½ log Kb
contoh :
Hitunglah pH larutan NaCH3COO dengan konsentrasi 0,1 M dan diketahui CH3COOH = 1,8 ´ 10-5.
Jawab : pOH = 7 - ½ log [A-] + ½ log Ka = 7 - ½ log (0,1) + ½ log (1,8 x 10-5) = 5,1
karena pH = 14 – pOH = 14 – 5,1 = 8,9




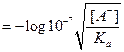

0 Komentar untuk "Hidrolisis Garam"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)