Apa yang dimaksud dengan larutan penyangga? Larutan penyangga adalah larutan yang tahan terhadap perubahan pH ketika sedikit asam atau basa ditambahkan ke dalamnya. Larutan penyangga dapat terbentuk dari asam lemah dengan garamnya, dan basa lemah dengan garamnya. Bagaimana larutan penyangga ini bekerja?
Larutan penyangga dari suatu asam lemah dengan garamnya biasanya memiliki pH kurang dari, contoh larutan penyangga asam asetat dengan natrium asetat yang memiliki pH 4,76. Asam asetat merupakan asam lemah, sehingga berada dalam kesetimbangan:
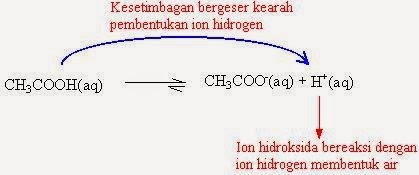
Penambahan natrium asetat pada larutan ini akan menambah jumlah ion asetat (CH3COO-). Berdasarkan asas Le Chatelier, kesetimbangan akan bergeser ke kiri, dimana ion asetat bergabung dengan ion H+ membentuk asam asetat. Penambahan basa, yang mengandung ion OH- pada larutan ini, akan menimbulkan reaksi:
sedangkan ketika ditambahkan asam, ion H+ akan bereaksi dengan CH3COO- membentuk CH3COOH, sehingga keberadaan ion OH- dari basa atau ion H+ dari asam tidak begitu berpengaruh selama masih terdapat sistem penyangganya.
Asam lemah akan mengalami kesetimbangan
Konstanta disosiasi asam ;
Untuk menentukan efek ion penyangga, maka :
tampak bahwa [H+], dapat dihubungkan sebagai :
Contoh :
Berapakah pH larutan CH3COOH 0,15 M dan 0,05 M NaCH3COO ? CH3COOH diketahui bernilai 1,8 x 10-5.
Kita juga dapat melakukannya dengan cara lain :
mulai : 0,15M 0,05 M 0 M
perubahan : -x x x
kesetimbangan : 0.15 – x 0,05 + x x
[CH3COO-] = 0,05 + x
[CH3COOH] = 0.15 – x
[H+] = x M
(1.8 ´ 10-5)(0.15 - x) = x 2 + 0.05 x
2.7 ´ 10-6 - 1.8 ´ 10-5 x = x 2 + 0.05 x
x 2 + 0.05 x - 2.7 ´ 10-6 = 0
Membentuk persamaan kuadrat dengan a = 1, b = 0.05, c = -2.7 ´ 10-6
nilai negatif tidak diambil, sehingga x = 5.39 ´ 10-5.
[H+] = 5.39 ´ 10-5
pH = -log(5.39 ´ 10-5) = 4.27
Hasil dengan menggunakan cara di atas hampir sama sehingga lebih praktis untuk menggunakan persamaan:
Pada larutan penyangga antara basa lemah dengan garamnya akan memiliki pH lebih besar dari 7, contoh campuran antara larutan amoniak dengan larutan ammonium klorida. Jika bercampur dengan konsentrasi yang tepat akan memiliki pH 9,25. Amoniak merupakan basa lemah yang mengalami kesetimbangan:
Keberadaan amonium klorida akan menambah jumlah ion ammonium. Dan ketika ada asam yang ditambahkan ion H+ dari asam akan bereaksi dengan ion OH-, dan akan menyebabkan pergeseran kesetimbangan ke arah pembentukan ion OH- .
Bagaimana perubahan pH jika ditambahkan basa atau asam ?
Misalkan pada campuran larutan CH3COOH 0,15 M dan 0,05 M NaCH3COO ditambahkan NaOH dengan konsentrasi 0,01 M. Hal ini tentu akan menyebabkan terjadinya pergeseran kesetimbangan pada :
sehingga dengan adanya [OH-] = 0,01 M :
mula-mula : 0,14M 0,06 M 0 M
Berubah : -x x x
kesetimbangan : 0.14 – x 0,06 + x x
[CH3COO-] = 0,06 + x
[CH3COOH] = 0.14 – x
[H+] = x M
(1.8 ´ 10-5)(0.14 - x) = x 2 + 0.06 x
2.52 ´ 10-6 - 1.8 ´ 10-5 x = x 2 + 0.06 x
x 2 + 0.06 x - 2.52 ´ 10-6 = 0
Pemecahan persamaan kuadratnya diperoleh :
Sehingga : [H+] = 4.20 ´ 10-5M
pH = -log(4.20 ´ 10-5) = 4.38
atau jika menggunakan persamaan :
Keberadaan ion-ion dalam darah pada tubuh kita berfungsi sebagai larutan penyangga, sehingga jika kita memakan makanan yang sedikit mengandung asam, atau basa atau bahkan garam maka tubuh kita akan menjaga agar pH dalam tubuh stabil. Tetapi jika berlebih maka kesetimbangannya akan bergeser dan fungsi tubuh kita pun terganggu.





![clip_image008[1] clip_image008[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjd62j-b6vs5YPupGmrOkHMGypu8KE6xOOoFiigfJ0FpUddC8cImGB24I3Wf8Ku5CDt-ZJjvOqNAdzRXOkzNpgahhkXoTWM0cveALzYKphVDqEQtj-VPLfgsLIwY0FZy_za_nYjFN8Mzac/?imgmax=800)


1 Komentar untuk "Definisi Larutan Penyangga"
terimakasih.
felia.Hutapea@yahoo.co.id
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)