Fakta bahwa molekul air membentuk ion H+ dan ion OH- dalam reaksi reversibel adalah dasar untuk definisi operasional asam dan basa yang lebih kuat dibanding definisi yang diusulkan oleh Arrhenius. Dalam langkah operasional, asam adalah zat yang meningkatkan konsentrasi ion H+ ketika dilarutkan dalam air. Basa adalah zat yang meningkatkan konsentrasi ion OH- ketika dilarutkan dalam air. Definisi tersebut dipakai sebagai teori dasar pengujian asam dan basa di laboratorium sederhana. Untuk memutuskan apakah senyawa tersebut asam atau basa kita melarutkannya dalam air dan menguji larutan dengan melihat apakah konsentrasi H+ atau OH-nya meningkat atau tidak. Tabel di bawah adalah ringkasan kecenderungan yang teramati dalam tiga kelompok senyawa. Logam Hidrida, logam oksida dan logam hidroksida sebagai basa. Nonlogam hidrida, nonlogam oksida dan nonlogam hidroksida sebagai asam.
| Asam | Hidrida Non-logam HF,HCl,HBr,HCN,HSCN, H2S | Oksida Non-logam CO2,SO2,SO3, NO2, P4O10 | Hidroksida Non-LogamHOCl,HONO2,O2S(OH)2, OP(OH)3 |
| Basa | Hidrida Logam HI,LiH,NaH, KH, MgH2, CaH2 | Oksida Logam Li2O,Na2O,K2O, MgO, CaO | Hidroksida Logam LiOH,NaOH,KOH, Ca(OH)2, Ba(OH)2 |
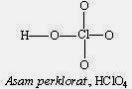
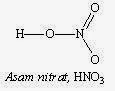
Struktur rangka untuk kedelapan asam oksi diberikan pada gambar di bawah. Secara umum, asam yang mengandung oksigen memiliki struktur rangka dimana keasaman hidrogen disebabkan oleh atom oksigen.
Gambar Struktur Lewis beberapa senyawa asam








0 Komentar untuk "Definisi operasional asam dan basa"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)