Pada umumnya definisi asam basa mengikuti apa yang dinyatakan oleh Arrhenius atau Bronsted-Lowry, tapi dengan adanya struktur yang diajukan Lewis muncul definisi asam dan basa baru. Asam Lewis didefinisikan sebagai spesi yang menerima pasangan elektron. Basa Lewis didefinisikan sebagai spesi yang memberikan pasangan elektron. Sehingga H+ adalah asam Lewis, karena ia menerima pasangan elektron, sedangkan OH- dan NH3 adalah basa Lewis, karena keduanya adalah penyumbang pasangan elektron.
Yang menarik dalam definisi asam Lewis adalah, terdapat senyawa yang tidak memiliki hidrogen dapat bertindak sebagai asam. Contoh, molekul BF3. Jika kita menentukan struktur Lewis dari BF3, tampak B kurang dari oktet dan dapat menerima pasangan elektron., sehingga dapat bertindak sebagai asam Lewis. Akibatnya dapat bereaksi dengan amoniak sebagai berikut:
Dalam kenyataan molekul yang tidak mencapai oktet sering merupakan asam Lewis yang kuat karena molekul tersebut dapat mencapai konfigurasi oktet dengan menerima pasangan elektron tak berikatan.
Senyawa yang termasuk dalam perioda yang lebih bawah dari perioda dua dapat bertindak sebagai asam Lewis sangat baik, dengan memperbanyak susunan valensi terluar mereka. Akibatnya, SnCl4 bertindak sebagai asam Lewis berdasarkan reaksi berikut:
Atom pusat dikelilingi oleh 12 elektron valensi, elektronnya menjadi lebih banyak dari 8.
Air dan nilai Kw
| Karena oksigen (dengan keelektronegatifan =3,44) adalah lebih elektronegatif dibandingkan hidrogen (keelektronegatifan = 2,20), elektron dalam ikatan H-O dalam air tidak terbagi secara seimbang antara atom hidrogen dan atom oksigen. Elektron tersebut digambarkan cenderung tertarik ke arah atom oksigen pada pusat molekul dan menjauh dari hidrogen atau yang lainnya. Akibatnya, molekul air menjadi polar. Atom oksigen membawa muatan partial negatif (d-), dan atom hidrogen partial positif (d+). |
Ketika air terdisosiasi untuk membentuk ion, molekul air kemudian membentuk ion bermuatan positif H+ dan ion OH- yang bermuatan negatif.
Reaksi sebaliknya dapat terjadi ion H+ dapat bergabung dengan ion OH- untuk membentuk molekul air yang netral.
Kenyataan bahwa molekul air terdisosiasi untuk membentuk ion H+ dan OH- yang kemudian dapat kembali membentuk molekul air, dinyatakan dalam persamaan berikut
Dalam Keadaan Seperti Apa Air Dapat Terdisosiasi untuk Membentuk Ion?
Pada suhu 25°C, berat jenis air adalah 0,9971 g/cm3, atau 0.9971 g/mL. Konsentrasi air adalah 55,35 molar.
Konsentrasi ion H+ dan OH- yang terbentuk karena disosiasi molekul H2O netral pada temperatur ini adalah 10-7 mol/L. Perbandingan konsentrasi ion H+ atau OH- dengan konsentrasi molekul H2O netral menjadi 1.8 ´ 10-9.
Nilai ini relatif tetap, dengan hanya sekitar 2 bagian dari sejuta molekul air yang terdisosiasi pada suhu ruangan. Kesetimbangan air dinyatakan sebagai:
Karena [H+] = [OH-] = 10-7 mol/L, dan K [H2O] relatif tetap, maka:
Kw = [H+] [OH-] = (1,0 ´ 10-7) ´ (1,0 ´10-7) = 1,0 ´ 10-14


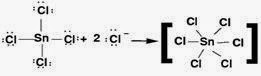


0 Komentar untuk "Asam Basa Lewis"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)