Rencana Pelaksanaan Pembelajaran
Satuan Pendidikan : SMA
Mata Pelajaran : Kimia
Kelas/Semester : XI/ 1
Standar Kompetensi : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, sifat molekul dan sifat-sifat senyawa
Kompetensi dasar : 1.3. menjelaskan interaksi antar molekul (gaya antar molekul) dengan sifatnya
Indikator : Menjelaskan pengertian dan macam-macam gaya antar molekul, menentukan jenis ikatan berdasarkan gaya antar molekul dan menganalisis hubungan antara gaya antar molekul dengan sifat-sifat molekul
Alokasi waktu : 30 menit
I. Tujuan
1. Siswa dapat menjelaskan pengertian dan macam-macam gaya antar molekul
2. Siswa dapat menentukan jenis ikatan berdasarkan gaya antar molekul
3. Siswa dapat menganalisis hubungan antar gaya antar molekul dengan sifat-sifat molekul
II. Materi Pembelajaran
1. Gaya London
2. Gaya tarik dipol-dipol
3. Gaya tarik dipol-dipol terimbas
4. Ikatan hidrogen
5. Gaya van der Waals
6. Ikatan ion
7. Jaringan ikatan kovalen raksasa
III. Metode Pembelajaran
1. Ceramah
Menjelaskan secara singkat tentang gaya antar molekul
2. Diskusi
Siswa berdiskusi dalam kelompoknya untuk menganalisis hubungan antar gaya antar molekul dengan sifat-sifat molekul
IV. Langkah Pembelajaran
| No | Langkah Pembelajaran | Perkiraan waktu | Nilai karakter budaya | |
| Guru | Siswa | |||
| 1 | a. Kegiatan awal 1. Membuka pelajaran Guru membuka pelajaran dan memeriksa kehadiran siswa 2. Apersepsi Guru menghubungkan materi yang akan diajarkan dengan permasalahan yang ada dalam kehidupan sehari-hari 3. Masalah/topik materi - Diantara air, alkohol dan larutan garam dapur, Manakah yang memiliki titik didih paling tinggi? 4. Tujuan pembelajaran Guru menjelaskan apa saja tujuan yang hendak dicapai pada materi kali ini | 1. Siswa menjawab perkataan guru 2. Siswa mendengarkan perkataan guru 3. Siswa menjawab pertanyaan yang dikatakan guru 4. Siswa menyimak tujuan pembelajaran yang disampaikan oleh guru | 5 menit | · Religius · Tanggung jawab · Rasa ingin tahu · Komunikatif · Kreatif · Jujur |
| | a. Kegiatan inti 1. Eksplorasi - Guru menjelaskan secara singkat tentang gaya antar molekul. - Guru membentuk kelompok @kelompok 3 anak. 2. Elaborasi - Guru memberikan .persoalan ke pada masing-masing kelompok. 3. Konfirmasi - Guru memberikan penilaian tentang hasil diskusi siswa. | - Siswa menyimak penjelasan guru - Siswa bergabung dalam kelompok-kelompok kecil - Secara berkelompok siswa mendiskusikan persoalan yang diberikan guru - Siswa menyampaikan hasil diskusinya tentang persoalan yang diberikan guru. | 20 menit | · Komunikatif · Rasa ingin tahu · Bekerja sama · Menghargai pendapat orang lain |
| | b. Penutup 1. Guru membuat kesimpulan tentang materi yang diajarkan. 2. Guru mengevaluasi ketercapaian tujuan pembelajaran. 3. Guru memberikan tugas rumah untuk mempelajari lebih lanjut gaya antar molekul. | 1. Siswa dan guru membuat kesimpulan tentang materi yang diajarkan 2. Siswa menyimak dan mendengarkan perkataan guru 3. Siswa menerima tugas yang diberikan guru | 5 menit | · Tanggung jawab · Disiplin · Kerja sama · Komunikatif · Menghargai orang lain |
V. Alat/Bahan/Sumber Belajar
1. Alat : Projektor, laptop dan flashdisk
2. Media : Powerpoint
VI. Sumber belajar
- Purba, Michael.2006.Kimia untuk SMA Kelas XI . Jakarta:Erlangga.
- Buku-buku lainnya yang relevan
VII. Penilaian
1. Jenis tes: Tes tertulis
2. Bentuk tes: Tes uraian
Format Pengamatan Nilai-Nilai Karakter
| No | Indikator nilai karakter | No daftar hadir peserta didik* | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | ||
| 1 | Menaati aturan diskusi seperti mengacungkan tangan apabila ingin maju mengerjakan latihan soal | | | | | | | | | | | | | |
| 2 | Menghargai jawaban yang telah dikerjakan oleh siswa lain | | | | | | | | | | | | | |
| 3. | Memberi kesempatan kepada anggota kelompok lain untuk mengerjakan latihan soal ke depan kelas | | | | | | | | | | | | | |
| 4. | Tanggung jawab terhadap tugas yang diberikan | | | | | | | | | | | | | |
| 5. | Keingintahuan terhadap materi yang diberikan | | | | | | | | | | | | | |
| Jumlah BT | | | | | | | | | | | | | | |
| Jumlah MT | | | | | | | | | | | | | | |
| Jumlah MB | | | | | | | | | | | | | | |
| Jumlah MK | | | | | | | | | | | | | | |
*) diisi dengan :
· BT ( Belum Terlihat) : Jika peserta didik belum memperlihatkan perilaku yang tertera dalam indicator
· MT (Mulai Terlihat) : Jika peserta didik mulai memperlihatkan perilaku yang tertera dalam indicator
· MB (Mulai berkembang) : Jika peserta didik mulai konsisten memperlihatkan perilaku yang tertera dalam indicator
· MK (Menjadi Kebiasaan) : Jika peserta didik telah konsisten memperlihatkan perilaku yang tertera alam indicator
Lembar Penilaian Afektif
Petunjuk:
Untuk setiap kegiatan, beri penilaian menggunakan skala berikut ini.
A : Sangat Baik
B : Memuaskan
C : Menunjukkan kemajuan
D : Memerlukan perbaikan
| No | Indikator penilaian | No Urut Siswa | Keterangan | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | | ||
| 1 | Bertanya | | | | | | | | | | | | | | |
| 2 | Menyumbang ide atau pendapat | | | | | | | | | | | | | | |
| 3 | Menjadi pendengar yang baik | | | | | | | | | | | | | | |
| 4 | Komunikasi | | | | | | | | | | | | | | |
VIII. Lampiran
1. Handout (Uraian Materi)
2. Media Pembelajaran (Power Point)
3. Soal
4. Kunci Jawaban
Mengetahui, Yogyakarta, Mei 2012
Dosen Pembimbing Mahasiswa
Dr. Eli Rohaeti Sri Rejeki Dwi Astuti
NIP. NIM.10303241015
Lampiran 1
Uraian materi
Gaya antar Molekul
1. Pengertian gaya antar molekul
Gaya tarik antar molekul adalah gaya tarik yang terjadi antara suatu molekul dan molekul tetangganya.Semua molekul mengalami gaya tarik antar molekul, meskipun pada beberapa kasus daya tarik yang terjadi sangatlah lemah. Gaya tarik antar molekul ini sangat mempengaruhi sifat fisis zat seperti titik leleh dan titik didih. Semakin kuat gaya tarik antar molekul, semakin sulit untuk memutuskan ikatannya sehingga semakin tinggi titik leleh maupun titik didihnya.
2. Macam-macam gaya antar molekul
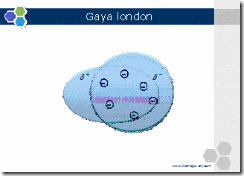
a. Gaya London
Gaya London adalah gaya tarik menarik yang terjadi antara molekul dalam zat yang nonpolar. Hal ini dapat dijelaskan karena elektron senantiasa bergerak dalam orbital. Perpindahan elektron dari suatu daerah ke daerah lain menyebabkan suatu molekul yang nonpolar menjadi polar sesaat, sehingga terbentuk dipol sesaat. Dipol yang terbentuk disebut dipol sesaat karena dapat berubah milyaran kali dalam satu detik. Dipol sesaat pada molekul dapat mengimbas molekul di sekitarnya sehingga membentuk suatu dipol terimbas sehingga menghasilkan gaya tarik menarik antar molekul yang lemah.
Kemudahan molekul untuk membentuk dipol sesaat atau mengimbas suatu dipol disebut polarisabilitas yang berkaitan dengan massa molekul relatif dan bentuk molekulnya. Pada umumnya, semakin banyak jumlah elektron dalam molekul semakin mudah mengalami polarisasi. Oleh karena jumlah elektron berkaitan dengan massa molekul relatif, maka semakin besar massa molekul relatif, semakin kuat gaya London
Gaya London merupakan gaya yang relatif lemah. Zat yang molekulnya bertarikan hanya berdasarkan gaya London, mempunyai titik leleh dan titik didih yang yang relatif rendah dibandingkan dengan zat lain yang massa molekul relatifnya sama. Jika molekul-molekulnya kecil, zat-zat ini biasanya berbentuk gas pada suhu kamar. Contoh: H2, O2, He, dll
b. Gaya Tarik Dipol-Dipol
Gaya tarik dipol-dipol adalah gaya antar molekul pada zat polar. Molekul yang terdistribusi rapatan elektronnya tidak simetris bersifat polar dan mempunyai dua ujung yang berbeda muatan. Molekul-molekul cenderung menyusun diri dengan ujung positif berdekatan dengan ujung negatif dari molekul di dekatnya.
Gaya tarik dipol-dipol lebih kuat dibandingkan gaya dispersi (gaya London), sehingga zat polar cenderung memiliki titik leleh dan titik didih lebih tinggi dibandingkan zat nonpolar yang memiliki massa molekul relatif yang sama. Sebenarnya gaya dispersi terdapat pada semua zat, baik nonpolar maupun polar. Pada zat nonpolar, gaya dispersi merupakan gaya satu-satunya yang dimiliki zat tersebut. Sementar pada zat polar, selain mempunyai gaya dispersi, juga mempunyai gaya dipol-dipol, sehingga gaya tarik antar molekul pada zat polar lebih kuat jika dibandingkan zat nonpolar. Contoh: HCl, HBr,dll
c. Gaya Tarik Dipol-Dipol Terimbas
Gaya tarik dipol-dipol terimbas adalah gaya antar molekul yang terjadi antara molekul polar dengan molekul nonpolar. Dalam hal ini, dipol dari molekul polar akan mengimbas molekul nonpolar disekitarnya, sehingga mengalami dipol sesaat. Hasilnya adalah suatu gaya tarik elektrostatik antara dipol dan dipol sesaat
d. Ikatan Hidrogen
Ikatan hidrogen qdalah gaya antar molekul gaya yang terjadi pada pada senyawa yang mempunyai ikatan F-H, O-H, N-H atau dengan kata lain antara atom hidrogen yang terikat pada atom yang berelektronegatifan besar dari molekul lain di sekitarnya. Oleh karena unsur F, O dan N sangat elektronegatif, maka ikatan F-H, O-H, N-H sangat polar, dimana atom H dalam senyawa tersebut sangat positif. Hal ini disebabkan oleh atom hidrogen hanya memiliki satu kulit atom sehingga jika awan elektronnya tertarik oleh atom lain, maka inti atomnya akan terpapar pada sisi sebaliknya. Akibatnya atom H dari satu molekul akan terikat kuat pada atom unsur yang sangat elektonegatif (F,O,N) dari molekul tetangganya melalui pasangan elektron bebas pada atom unsur berkeelektronegatian besar.
Ikatan hidrogen lebih kuat daripada gaya van der Waals dan energi yang diperlukan untuk memutuskan ikatan hidrogen sangat tinggi, sehingga titik didihnya pun relatif tinggi. Energi untuk memutuskan ikatan hidrogen adalah sebesar 15 sampai 40 kJ/mol sedangkan untuk gaya van der Waals adalah sekitar 2 sampai 20 kJ/mol. Contoh : HF, NH3, dll
e. Gaya van der Waals
Gaya-gaya antar molekul secara kolektif disebut gaya van der Waals. Yang termasuk gaya van der Waals adalah gaya london, gaya dipol-dipol dan gaya dipol-dipol terimbas. Namun demikian, ada kebiasaan untuk melakukan perbedaan dengan tujuan untuk memperjelas gaya antar molekul dalam zat sebagai berikut
- Istilah gaya London digunakan jika gaya antar molekul itulah satu-satunya yaitu untuk zat nonpolar
- Istilah gaya van der Waals digunakan untuk zat yang mempunyai gaya dipol-dipol disamping gaya dispersinya, misalnya hidrogen klorida dan aseton
f. Ikatan ionik
Ikatan Ionik adalah gaya tarik menarik listrik antar ion yang berbeda muatan dan ikatannya bekerja ke segala arah dalam struktur krisral zat. Setiap ion dalam kristal ion terikat sama kuat pada beberapa ion disekitarnya.
Senyawa logam dan nonlogam cenderung bersifat ionik namun tidak selalu demikian. Jenis ikatan dalam suatu senyawa dapat dikenali dari sifat-sifatnya. Senyawa ion mempunyai sifat-sifat sebagai berikut:
- Mempunyai titik leleh dan titik didih yang tinggi. Semua senyawa ion berupa padatan pada suhu kamar. Hal ini menunjukkan bahwa ikatan ion adalah ikatan yang relatif kuat
- Padatannya tidak menghantarkan listrik tetapi lelehannya merupakan konduktor. Hal ini terjadi karena dalam keadaan cair, ion-ionnya dapat bergerak
- Baersifat rapuh atau getas. Hal ini terjadi karena ikatan ion tidak dapat bergeser disebabkan pergeseran lapisan akan menghasilkan gaya tolak-menolak listrik antar ion sejenis, sehingga kristal terbelah (pecah)
Contoh : AlF3, AlCl3 dll
g. Jaringan Ikatan kovalen raksasa
Jaringan ikatan kovalen raksasa adalah suatu jenis ikatan antar partikel yang sangat kuat karena membentuk struktur kovalen raksasa. Zat dengan ikatan seperti ini mempunyai titik leleh dan titik didih yang sangat tinggi. Pada zat yang ikatan antar partikel berupa jaringan ikatan kovalen, antar atomnya saling terikat dengan ikatan kovalen. Zat dengan ikatan seperti itu mempunyai titik leleh dan titik didih yang luar biasa tinggi. Contoh : karbon dan silika (SiO2)
Lampiran 2
Lampiran 3
Lembar Kerja Siswa
Gaya antar Molekul
Pendahuluan: Gaya tarik antar molekul adalah gaya tarik yang terjadi antara suatu molekul dan molekul tetangganya. Ada beberapa macam gaya tarik antar molekul yaitu gaya london, gaya tarik dipol-dipol, gaya tarik dipol-dipol terimbas, ikatan hidrogen, gaya van der Waals, ikatan ionok dan ikatan kovalen raksasa.
Tujuan : - Siswa dapat menjelaskan pengertian dan macam-macam gaya antar molekul
- Siswa dapat menentukan jenis ikatan berdasarkan gaya antar molekul
- Siswa dapat menganalisis hubungan antar gaya antar molekul dengan sifat-sifat molekul
- Siswa dapat memperkirakan sifat fisika dan kimia suatu molekul berdasarkan perbedaan gaya antar molekul
a. Soal untuk diskusi kelompok
Kelompok 1
Identifikasi gaya tarik menarik yang terjadi pada metana (CH4) dan ramalkan titik didih dan titik lelehnya
Kelompok 2
Identifikasi gaya tarik menarik yang terjadi pada hidrogen klorida (HCl) dan ramalkan titik didih dan titik lelehnya
Kelompok 3
Identifikasi gaya tarik menarik yang terjadi pada air (H2O) dan ramalkan titik didih dan titik lelehnya
Kelompok 4
Identifikasi gaya tarik menarik yang terjadi pada silika dioksida (SiO2) dan ramalkan titik didih dan titik lelehnya
b. Soal individu
Jawablah pertanyaan di bawah ini!
1. Diketahui massa molekul dari beberapa zat sebagai berikut : N2= 28, O3= 48, F2=38, Ar= 40, dan Cl2=72. Susunlah zat-zat tersebut berdasarkan titik didihnya
2. Ikatan C=O dalam CO2 cukup kuat, tetapi CO2 mempunyai titik didih yang rendah, mengapa demikian?
3. Jelaskan mengapa natrium klorida (NaCl) mempunyai titik leleh serta titik didih yang sangat tinggi?
4. Senyawa CO2 mempunyai titik didih yang rendah, sedangkan SiO2 mempunyai titik didih sangat tinggi. Jelaskan perbedaan tersebut
Lampiran 4
Kunci jawaban
a. Soal untuk diskusi kelompok
Kelompok 1
Gaya tarik-menarik antar molekul yang terdapat pada metana (CH4) adalah gaya london karena senyawa metana adalah senyawa kovalen nonpolar . Karena gaya antar molekulnya adalah gaya london, maka gaya tarik menarik antar partikelnya relatif lemah, sehingga titik leleh dan titik didihnya pun rendah. Karena titik didihnya rendah dan gaya tarik antar molekulnya lemah, metana berwujud gas pada suhu ruangan
Kelompok 2
Gaya tarik-menarik antar molekul yang terdapat pada hidrogen klorida (HCl) adalah gaya tarik dipol-dipol karena HCl adalah senyawa kovalen polar dan memiliki perbedaan keelektronegatifan yang besar, sehingga mudah membentu dipol positif dan dipol negatif. Karena gaya antar molekulnya adalah gaya tarik dipol-dipol, maka gaya tarik menarik antar partikelnya relatif kuat, sehingga titik leleh dan titik didihnya relatif tinggi. Karena titik didihnya relatif tinggi dan gaya tarik antar molekulnya kuat, HCl berwujud cair pada suhu ruangan
Kelompok 3
Gaya tarik-menarik antar molekul yang terdapat pada air(H2O) adalah ikatan hidrogen karena air adalah senyawa kovalen polar dan pada ikatannya terdapat ikatan antara atom O-H yang merupakan ikatan hidrogen . Karena gaya antar molekulnya adalah ikatan hidrogen, maka gaya tarik menarik antar partikelnya relatif kuat, sehingga titik leleh dan titik didihnya pun tinggi. Karena titik didihnya tinggi dan gaya tarik antar molekulnya kuat, metana berwujud cair pada suhu ruangan
Kelompok 4
Gaya tarik-menarik antar molekul yang terdapat pada silika (SiO2) adalah ikatan kovalen raksasa karena Silika adalah senyawa kovalen yang membentuk struktur kovalen raksasa. Karena gaya antar molekulnya adalah ikatan kovalen raksasa, maka gaya tarik menarik antar partikelnya sangat kuat, sehingga titik leleh dan titik didihnya sangat tinggi. Karena titik didihnya sangat tinggi dan gaya tarik antar molrkulnya sangat kuat , silika berwujud padat pada suhu ruangan
b. Soal individu
1. Susunan zat-zat berdasarkan titik didihnya adalah
N2 < F2 < Ar < O3 < Cl2
2. Ikatan C=O dalam CO2 cukup kuat, tetapi CO2 mempunyai titik didih yang rendah hal ini disebabkan oleh gaya tarik antar molekul CO2 adalah gaya London karena senyawa CO2 adalah senyawa kovalen polar sehingga gaya tarik antar molekulnya relatif rendah, sehingga energi yang digunakan untuk memutuskan ikatan C=O rendah. Hal ini menyebabkan titik didih CO2 relatif rendah
3. Natrium klorida (NaCl) mempunyai titik leleh serta titik didih yang sangat tinggi karena ikatan pada senyawa NaCl adalah ikatan ionik sehingga gaya tarik antar molekul NaCl sangat kuat, sehingga energi yang diperlukan untuk memutuskan ikatan antara Na-Cl sangat besar, sehingga titik didih serta titik lelehnya sangat tinggi
4. Senyawa CO2 mempunyai titik didih yang rendah, sedangkan SiO2 mempunyai titik didih sangat tinggi hal ini disebabkan senyawa CO2 memiliki ikatan kovalen (hanya tersusun antara atom O=C=O)dan bersifat nonpolar sehingga gaya tarik antar molekulnya relatif rendah . Sedangkan pada silika mempunyai ikatan kovalen raksasa (setiap atom Si mengikat 4 atom O dan setiap atom O mengikat 2 atom Si) sehingga gaya tarik antar molekulnya sangat kuat
















9 Komentar untuk "RPP Ikatan Kimia (Gaya Antar Molekul)"
artikel dikirim ke email kan ya?
latifadillah25@gmail.com
nugrahahari266@gmail.com
mappatunrumaslan@gmail.com
yayang.nurwanda14@mhs.uinjkt.ac.id
delviaramadhaniys@gmail.com
ismatulmuhibah115@gmail.com
RPP nya sangat Bagus.. mohon bisa untuk dikirim ke email saya: qisyati84@gmail.com
tolong kirim rpp nya ke email saya ya.akan sangat membantu saya.terima kasih
srihidrayati23@gmail.com
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)