Rencana Pelaksanaan Pembelajaran
Nama Sekolah : SMA N 2 Sleman
Mata Pelajaran : Kimia
Kelas/Semester : XI/1
Pertemuan Ke- : 2
Alokasi Waktu : 1 jam pelajaran
Standar Kompetensi : 1. Memahami struktur atom untuk meramalkan sifat-sifat
periodik unsur, struktur molekul, dan sifat-sifat senyawa
Kompetensi Dasar : 1.1 Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfi gurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik
Indikator : • Menjelaskan geometri molekul berdasarkan teori hibridisasi.
I. Tujuan Pembelajaran
Setelah mempelajari materi ini, diharapkan siswa dapat
Ø Menjelaskan geometri molekul berdasarkan teori hibridisasi.
II. Uraian Materi Pembelajaran
1. Hibridisasi
Teori domain elektron dapat digunakan untuk meramalkan bentuk molekul,tetapi teori ini tidak dapat digunakan untuk mengetahui penyebab suatu molekul dapat berbentuk seperti itu. Sebagai contoh, teori domain elektron meramalkan molekul metana (CH4) berbentuk tetrahedron dengan 4 ikatan C-H yang ekuivalen dan fakta eksperimen juga sesuai dengan ramalan tersebut, akan tetapi mengapa molekul CH4 dapat berbentuk tetrahedron?

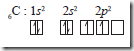
Dengan konfigurasi elektron seperti itu, atom C hanya dapat membentuk 2 ikatan kovalen (ingat, hanya elektron tunggal yang dapat dipasangkan untuk membentuk ikatan kovalen). Oleh karena ternyata C membentuk 4 ikatan kovalen, dapat dianggap bahwa 1 elektron dari orbital 2s dipromosikan ke orbital 2p, sehingga C mempunyai 4 elektron tunggal sebagai berikut.
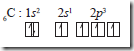
Namun demikian, keempat elektron tersebut tidaklah ekuivalen dengan satu pada satu orbital 2s dan tiga pada orbital 2p, sehingga tidak dapat menjelaskan penyebab C pada CH4 dapat membentuk 4 ikatan ekuivalen yang equivalen. Untuk menjelaskan hal ini, maka dikatakan bahwa ketika atom karbon membentuk ikatan kovalen dengan H membentuk CH4, orbital 2s dan ketiga orbital 2p mengalami hibridisasi membentuk 4 orbital yang setingkat. Orbital hibridanya ditandai dengan sp3 untuk menyatakan asalnya, yaitu satu orbital s dan 3 orbital p.
C: 1s2 2s1 2p3 mengalami hibridisasi menjad i 6C : 1s2 (2sp3)4
Hibridisasi tidak hanya menyangkut tingkat energi, tetapi juga bentuk orbital gambar.
Sekarang, C dengan 4 orbital hibrida sp3, dapat membentuk 4 ikatan kovalen yang equivalen. Jadi, hibridisasi adalah peleburan orbital-orbital dari tingkat energi yang berbeda menjadi orbital-orbital yang setingkat.

III. Metode Pembelajaran
Ceramah, tanya jawab, dan latihan soal
IV. Langkah-langkah Pembelajaran
| Tahap-tahap | Alokasi Waktu | Langkah Pembelajaran | Karakter |
| Pra Pembukaan | 2 menit | - Guru memasuki kelas dan memberi salam - Mengkondisikan kelas - Mengecek kehadiran siswa | Jujur, disiplin, peka |
| Pembukaan | 3 menit | a. Apersepsi Mengingatkan materi sebelumnya tentang teori domain elektron dala penentuan geometri molekul b. Motivasi Guru menjelaskan bahwa selain teori domain elektron, geometri molekul dapat ditentukan dengan teori hibridisasi | Rasa ingin tahu, komunikatif, berani bertanya. |
| Kegiatan Inti | 38 menit | Eksplorasi : Ø Siswa diberi kesempatan untuk mencari dan membaca bahan materi pembelajaran mengenai teori hibridisasi Elaborasi : Ø Guru menjelaskan teori domain elektron dengan media powerpoint Ø Guru dan siswa melakukan tanya jawab Ø Guru memberikan beberapa latihan soal tentang teori domain elektron Ø Guru meminta beberapa siswa untuk mengerjakan soal ke depan kelas Konfirmasi : Ø Guru mengkoreksi jawaban siswa Ø Guru membetulkan jawaban siswa yang kurang tepat | Peka, demokrasi, komunikatif. Kerjasama, jujur, disiplin, tanggungjawab. Tanggungjawab, kritis, teliti. |
| Penutup | 2 menit | Evaluasi : Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya memberikan kontribusi pada tanya jawab dan latihan soal Simpulan : Guru menyimpulkan teori hibridisasi bersama siswa. Tugas : Guru memberikan tugas untuk mempelajari materi selanjutnya | Tanggungjawab, kritis, teliti |
V. Alat dan Sumber Belajar
Ø Alat : Papan tulis,Kapur,LCD dan laptop
Ø Sumber Belajar:
Das Salirawati dkk. (2007). Belajar Kimia Secara Menarik untuk SMA Kelas XI. Jakarta: PT Gramedia Widiasarana Indonesia
Sri Rahayu Ningsih, dkk. (2007). Sains Kimia 2 SMA/MA. Jakarta: PT Bumi Aksara
VI. Penilaian
a. Teknik Penilaian: Tes tertulis
a. Bentuk Instrumen: Soal pilihan ganda dan soal esay
| Mengetahui, Guru Pembimbing Eni Purwantini NIP. 19610201 198601 2 001 | Yogyakarta, 3 September 2013 Mahasiswa Muhammad Radityo NIM. 10303241025 |


0 Komentar untuk "RPP Hibridisasi"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)