Fenomena tetapan kesetimbangan ditemukan oleh Cato Maximillan dan Peter Waage pada tahun 1866 yang dikenal dengan Hukum Aksi Massa. Penulisan tetapan kesetimbangan untuk reaksi yang berlangsung secara homogen, kita misalkan reaksi secara umum :
Kamu biarkan reaksi ini mencapai kesetimbangan dan kemudian diukur konsentrasi semua zat pada saat kesetimbangan.
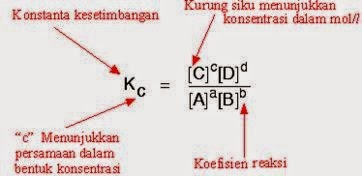
Menurut Waage, pada suhu tetap berlaku hukum kesetimbangan yang berbunyi “Pada reaksi kesetimbangan, hasil kali konsentrasi hasil reaksi yang dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat pereaksi yang dipangkatkan koefisiennya akan tetap, pada suhu tetap.”
Sehingga reaksi :
dapat dituliskan sebagai :
Nilai Kc disebut tetapan kesetimbangan. Untuk reaksi uap air dengan karbon panas yang merah, berarti zat yang berbentuk gas kontak dengan sebuah padatan.
Tetapan kesetimbangannya dinyatakan sebagai :
Sedangkan untuk reaksi antara tembaga dengan larutan perak nitrat, kita akan memperoleh kesetimbangan antara padatan dan larutan ion
tetapan kesetimbangan dinyatakan sebagai :
Jadi untuk reaksi antara gas dan padatan atau larutan, harga tetapan kesetimbangan hanya ditentukan oleh konsentrasi gas, sedangkan jika reaksinya merupakan reaksi anatara zat dengan fasa larutan dan padatan yang menentukan nilai tetapan kesetimbangannya adalah konsentrasi larutannya.
Untuk lebih memahami tentang hukum ini, berikut adalah data beberapa harga tetapan kesetimbangan reaksi antara CO dengan H2 pada suhu tetap dengan konsentrasi yang berbeda.
Reaksinya:
dan tetapan kesetimbangannya dinyatakan sebagai :
Tabel 6.1 Data percobaan pada suhu tetap.
|
| Percobaan 1 | Percobaan 2 | Percobaan 3 |
| Sebelum reaksi [CO] [H2] [CH4] [H2O] |
0,1000 mol L-1 0,3000 mol L-1 - - |
0,2000 mol L-1 0,3000 mol L-1 - - |
- - 0,1000 mol L-1 0,1000 mol L-1 |
| Kesetimbangan [CO] [H2] [CH4] [H2O] |
0,0613 mol L-1 0,1839 mol L-1 0,0387 mol L-1 0,0387 mol L-1 |
0,1522 mol L-1 0,1566 mol L-1 0,0478 mol L-1 0,0478 mol L-1 |
0,0613 mol L-1 0,1839 mol L-1 0,0387 mol L-1 0,0387 mol L-1 |
|
3,93 |
3,91 |
3,93 |
Sehingga diperoleh harga K rata-rata = 3,93. Konstanta atau tetapan kesetimbangan akan selalu memiliki nilai atau besar yang sama selama kita tidak mengubah suhunya, walaupun kita melakukan dengan konsentrasi dan tekanan yang berbeda-beda, bahkan jika kita mengunakan katalis pun tidak akan mengubahnya. Harga tetapan kesetimbangan dapat dinyatakan berdasarkan konsentrasi dan tekanan.


0 Komentar untuk "Tetapan Kesetimbangan"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)