Sebelum mempelajari tentang tetapan kesetimbangan berdasarkan tekanan, kita terlebih akan mencoba terlebih dahulu mempelajari tentang tekanan parsial dan fraksi mol. Tekanan parsial suatu gas adalah tekanan yang akan dimiliki jika suatu gas mengisi suatu wadah tanpa ada zat yang lain. Tekanan parsial gas A diberi lambang PA. Sedangkan tekanan parsial gas B diberi lambang PB, dan seterusnya.
Tekanan total suatu campuran gas merupakan jumlah dari tekanan parsial gas-gas campurannya.
P = PA + PB + PC + ……..
Gambarannya dapat dilihat sebagai berikut :
Gas A menimbulkan tekanan ketika pada tembok (dengan tekanan parsialnya), begitu juga dengan gas B.
Fraksi mol merupakan perbandingan mol suatu zat terhadap keseluruhan mol dari campuran pembentuknya. Fraksi mol suatu zat A ditunjukkan sebagai XA, farksi mol zat B sebagai XB, dan seterusnya.
Contoh, dalam campuran gas terdapat 1 mol gas nitrogen dan 3 mol gas hidrogen, maka terdapat 4 mol total gas yang ada. Fraksi mol dari gas nitrogen adalah ¼ (0,25) dan fraksi mol gas hidrogen adalah ¾ (0,75).
Hubungan fraksi mol dan tekanan parsial ditunjukkan sebagai tekanan parsial merupakan hasil kali dari fraksi mol dengan tekanan total, atau :
Hal ini berarti jika kamu memiliki campuran yang terdiri dari 20 mol gas nitrogen, 60 mol gas hidrogen dan 20 mol gas amoniak(total mol = 100 mol), pada tekanan 200 atm, maka tekanan parsial dapat ditentukan sebagai berikut :
| Gas | Fraksi mol | Tekanan Parsial |
| nitrogen | 20/100 = 0.2 | 0.2 x 200 = 40 atm |
| hidrogen | 60/100 = 0.6 | 0.6 x 200 = 120 atm |
| ammonia | 20/100 = 0.2 | 0.2 x 200 = 40 atm |
Kesetimbangan berdasarkan tekanan dinyatakan dengan notasi Kp, yaitu hasil kali tekanan parsial gas-gas hasil reaksi dibagi dengan hasil kali tekanan parsial gas-gas pereaksi, setelah masing-masing gas dipangkatkan dengan koefisiennya menurut persamaan reaksi.
Kesetimbangan homogen dalam bentuk tekanan, untuk reaksi antara gas A dan B membentuk gas C dan D sesuai reaksi :
dapat dituliskan sebagai :
sehingga untuk reaksi dalam fasa homogen:
dapat dituliskan sebagai :
Kesetimbangan heterogen dalam bentuk tekanan seperti halnya dalam Kc keterlibatan zat dengan fasa padat diabaikan, karena tidak berperan dalam pembentukan tekanan total. Untuk menentukan Kp tekanan gas dapat dinyatakan dengan cmHg atau atmosfer (atm).
dituliskan sebagai :
Contoh
Pada temperatur 500 K ke dalam bejana yang volumnya 5 liter dimasukkan 0,6 mol gas HI sehingga terjadi reaksi kesetimbangan :
Bila setelah sistem mencapai keadaan kesetimbangan masih terdapat 0,3 mol HI, tentukan harga tetapan kesetimbangan Kp pada temperatur 500 K (R = 0,082).
Jawab:
Untuk mendapatkan harga P, gunakan rumus PV = nRT
Mula-mula : 0,6 mol 0 mol 0 mol
Berubah : -0,3 0,15 0,15
Kesetimbangan : 0,3 0,15 0,15
Mol total = 0, 6 mol
XHI = 0,3/0,6 = ½
XH = XI = 0,15 /0,6 = ¼
PHI = ½ x 4,92 PH = ¼ x 4,92 PH = ¼ x 4,92
= 2.46 = 1.23 = 1.23



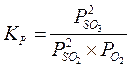


0 Komentar untuk "Tetapan Kesetimbangan Berdasarkan Tekanan"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)