1 . Dari beberapa unsur berikut yang mengandung :
1. 20 elektron dan 20 netron
2. 10 elektron dan 12 netron
3. 15 proton dan 16 netron
4. 20 netron dan 19 proton
5. 12 proton dan 12 netron
Yang memiliki sifat mirip dalam sistem periodik adalah ........
A . 1 dan 2
B . 2 dan 3
C . 2 dan 4
D . 3 dan 4
E . 1 dan 5
Kunci : E
Penyelesaian :
1. 20 elektron dan 20 neutron
20X 4 2 8 8 2 : Golongan IIA, Periode 4
2. 10 elektron dan 12 neutron
10X 2 8 : Golongan VIII A, Periode 2
3. 15 proton dan 16 neutron
15X 2 8 5 : Golongan VA, Periode 3
4. 20 neutron dan 19 proton
19X 4 2 8 8 1 : Golongan IA, Periode 4
5. 12 proton dan 12 neutron
12X 2 8 2 : Golongan IIA, Periode 3
Unsur yang terletak di dalam satu satu golongan akan memiliki sisfat yang mirip jadi pilihanyang tepat adalah 1 dan 5.
2 . Berdasarkan tabel berikut :
Molekul PH3 memiliki titik didih terendah. Penyebabnya adalah ........
A . Mr terkecil
B . Molekulnya kecil
C . Terdapatnya ikatan hidrogen
D . Terdapatnya ikatan gaya London
E . Terdapatnya ikatan gaya van der walls
Kunci : E
Penyelesaian :
Pada molekul PH3, terdapat ikatan gaya Van der Waals. Ikatan Van der Waals jauh lebih
rendah daripada ikatan hidrogen. Energi untuk memutuskan ikatan hidrogen sekitar 15 s/d 40 kJ/mol, sedangkan untuk gaya Van der Waals sekitar 2 s/d 20 kJ/mol. Itulah sebabnya ikatan Van der Waals mempunyai titik cair dan titik didih lebih rendah.
3 . Berdasarkan gambar di bawah :
Jika skala menunjukkan x lt, berarti gas yang dihasilkan x lt adalah ........ (Ar Mg =24)
A . 3,361t
B . 3,601t
C . 22,41t
D . 7,20 It
E . 14,41t
Kunci : B
Penyelesaian :
mol Mg = = 0,25 mol
mol HCl = 300 x 1 = 300 mmol = 0,3 mol
Mg (s) + 2 HCl (aq) MgCl 2 (aq) + H2 (g)
m : 0,25 0,3
b : 0,15 0,3
s : 0,1 0
HCl habis bereaksi.
mol H2 = mol HCl = x 0,3 = 0,1 mol
T = 27°C = 300 K
PV = n R T
V = = 3,60 liter
4 . Tabung gas LPG mengandung gas propana (C3H8) dan gas butana (C4H10) di mana
sangat dipergunakan dalam kehidupan rumah tangga selain minyak tanah.
Jika campuran gas yang terdapat pada tabung pada gambar di atas volumenya 20 1iter
dibakar dengan udara yang mengandung 20% gas oksigen, maka udara yang diperlukan
sebanyak ........
A . 500 liter
B . 650 liter
C . 1000 liter
D . 1150 liter
E . 1300 liter
Kunci : D
Penyelesaian :
(C3H8 + C4H10) + O2 7 CO2 + 9 H2O
20 liter
Udara mengandung 20% gas oksigen, maka :
Volume udara yang diperlukan = x 230 = 1150 liter.
5 . Berdasarkan tabel berikut :
Urutan unsur-unsur tersebut dalam suatu perioda dari kiri ke kanan adalah ........
A . T, Q, R, S dan P
B . T, R, Q, P dan S
C . T, P, Q, R dan S
D . T, S, Q, R dan P
E . T, Q, S, R dan P
Kunci : B
Penyelesaian :
Dalam satu periode, dari ke kanan, energi ionisasi cenderung Semakin besar.
T(738) < R(786) < Q(1012) < P(1251) < S(1521)
6 . Berdasarkan gambar berikut :
Ikatan kovalen koordinasi terletak pada nomor ........
A . 1
B . 2
C . 3
D . 4
E . 5
Kunci : B
Penyelesaian :
Ikatan kovalen koordinasi adalah ikatan kovalen di mana pasangan elekron yang dipakai
bersama hanya berasal dari salah satu atom. Ikatan antara N dan O, pasangan elektron
yang dipakai bersama hanya berasal dari atom N.
7 . Berdasarkan tabel berikut :
Senyawa yang paling polar di bawah ini adalah ........
A . CO2
B . ClO
C . CH4
D . HCl
E . PH3
Kunci : D
Penyelesaian :
Berdasarkan tabel, selisih keelektronegatifan :
- CO2 = 3,5 - 2,5 = 1
- ClO = 3,5 - 3,0 = 0,5
- CH4 = 2,5 - 2,1 = 0,4
- HCl = 3,0 - 2,1 = 0,9
- PH3 = 2,1 - 2,1 = 0
Walaupun selisih keelektronegatifan pada CO2 tertinggi, tetapi CO2 termasuk non-polar
sebab distribusi elektronnya merata/simetris sehingga saling meniadakan. Senyawa yang
paling polar adalah senyawa yang memiliki selisih keelektronegatifan besar, tetapi distribusi
elektronnya tidak simetris/merata (tertarik pada salah satu kutub).
Jadi senyawa yang paling polar adalah HCl.
8 . Diketahui kurva reaksi sebagai berikut :

A . H1 - H2 - H3
B . H1 + H2 - H4
C . H1 - H3 - H4
D . H1 - H3 + H4
E . H1 + H3 + H4
Kunci : C
Penyelesaian :
Berdasarkan kurva di atas diperoleh :
H1 = H2 + H3 + H4
H2 = H1 - H3 - H4
9 . Di antara data kondisi reaksi berikut :
Manakah laju reaksinya paling rendah ........
A . 1
B . 2
C . 3
D . 4
E . 5
Kunci : C
Penyelesaian :
Laju reaksi dipengaruhi oleh faktor :
- Luas permukaan zat : berupa serbuk laju reaksi semakin besar.
- Konsentrasi : konsentrsi semakin tinggi laju reaksi semakin besar
- Suhu : suhu semakin tinggi laju reaksi semakin besar
Jadi, laju reaksi paling rendah adalah zat yang berupa lempeng dengan suhu yang paling
rendah.
10 . Hasil uji daya hantar listrik terhadap larutan A dan B diperoleh hasil sebagai berikut. Pada
larutan A, lampu menyala dan terbentuk gelembung-gelembung gas, pada larutan B lampu
tidak menyala dan terbentuk gelembung-gelembung gas. Kesimpulan yang dapat Anda
tarik dari data tersebut adalah ........
A . larutan A adalah elektrolit karena mudah larut dalam air
B . larutan A adalah non-elektrolit karena hanya menghasilkan gelembung-gelembung
C . larutan B adalah elektrolit karena tidak menghasilkan gelembung-gelembung
D . larutan A adalah non-elektrolit karna terurai menjadi ion-ion yang menyalakan lampu
E . larutan B adalah elektrolit karena terurai menjadi ion-ion menghasilkan gelembung-gelembung.
Kunci : E
Penyelesaian :
- Larutan elektrolit: dapat terionisasi
- Non-elektrolit: tidak dapat terionisasi
Lihat gambar di bawah ini :
11 . Perhatikan tabel Ka dan beberapa asam berikut:
Di antara asam di atas yang paling lemah adalah ........
A . HL
B . HD
C . HB
D . HC
E . HE
Kunci : B
Penyelesaian :
Semakin besar harga Ka, maka sifat asamnya akan semakin kuat. Urutan sifat keasaman
berdasarkan tabel harga Ka :
HD < HA < HB < HE < HK < HG < HC < HL
(HD : asam paling lemah, karena harga Ka-nya paling kecil yaitu 1,8 . 10 -12)
12 .
Berdasarkan hasil titrasi yang alatnya dan gambarnya seperti di atas diperoleh data sebagai
berikut :
Maka konsentrasi HC1 adalah ........
A . 0,05 M
B . 0,08 M
C . 0,1 M
D . 1 M
E . 0,04 M
Kunci : E
Penyelesaian :
Volume HCl (V1) = 25 ml
Konsentrasi HCl (M1) = X M
Volume NaOH (V2) = Volume rata-rata
=
= 10,2 ml
Konsentrasi NaOH (M2) = 0,1 M
Molaritas HCl dan NaOH = Normalitasnya (karena asam bervalensi satu dan basa
bervalensi satu).
M = N
V1 . N1 = V2 . N2
25 . X = 10,2 . 0,1
X =
= 0,04 M
13 . Berdasarkan pasangan larutan berikut ini :
1. 50 mL CH3COOH 0,2 M dan 50 mL NaOH 0,1 M
2. 50 mL CH3COOH 0,2 M dan 100 mL NaOH 0,1 M
3. 50 mL H2CO3 0,2 M dan 100 mL NH3 (aq) 0,1 M
4. 50 mL HCl 0,1 M dan 50 mL NH3(aq) 0,2 M
5. 50 mL HCl 0,1 M dan 50 mL NaOH 0,2 M
Pasangan-pasangan yang pH-nya tidak akan berubah apabila ditambah sedikit larutan basa
kuat atau asam kuat adalah ........
A . 1 dan 2
B . 1 dan 3
C . 1 dan 4
D . 2 dan 3
E . 1 dan 5
Kunci : C
Penyelesaian :
Larutan penyangga adalah larutan yang dapat mempertahankan harga pH. Larutan
penyangga terdiri dari campuran :
- Asam lemah dengan garamnya
Contohnya CH3COONa, CH3COOK dsb
- Basa lemah dengan garamnya
Contohnya NH4Cl, (NH4) 2SO4 dsb.
1. CH3COOH + NaOH CH3COONa + H2O
m : 10 mmol 5 mmol
b : 5 5
s : 5 mmol - 5 mmol
(asam lemah dengan garamnya)
2. CH3COOH + NaOH CH3COONa + H2O
m : 10 mmol 10 mmol
b : 10 10
s : - - 10 mmol
(habis bereaksi, tinggal garamnya)
3. H2CO3 + 2 NH3 (NH4) 2CO3
m : 10 mmol 10 mmol
b : 5 10
s : 5 mmol - 5 mmol
(bukan penyangga, karena asam dan basanya dua-duanya lemah)
4. HCl + NH3 NH4Cl
m : 5 mmol 10 mmol
b : 5 5
s : - 5 mmol 5 mmol
(basa lemah dengan garamnya)
5. HCl + NaOH NaCl + H2O
m : 5 mmol 10 mmol
b : 5 5
s : - 5 mmol 5 mmol
(asam kuat dan basa kuat yang tersisa basa kuat, pH basa kuat)
14 . Berdasarkan gambar berikut :
Jika garam-X terdiri dari asam lemah dan basa kuat, maka Mr garam-X adalah ........
(Ka = 2 .10 -4; Kw =10 -14)
A . 13,6
B . 10,2
C . 6,8
D . 3,4
E . 1,7
Kunci : C
Penyelesaian :
pH = 9
pOH = 14 - 9 = 5, maka [OH -] = 10 -5
15 . Diketahui : Ksp Ag 2CO3 = 8 x 10 -12
Ksp AgCl = 2 x 10 -10
Ksp Ag 3PO4 = 1 x 10 -16
Ksp AgI = 8,5 x 10 -17
Ksp AgCN =1,2 x 10 -16
Berdasarkan data tersebut, garam yang paling besar kelarutannya dalam air adalah ........
A . AgCl
B . A3PO4
C . AgI
D . Ag 2CO3
E . AgCN
Kunci : D
Penyelesaian :
Ksp = (n - 1) n-1s n
a. Ag 2CO3 2 Ag + CO3 2-
Ksp Ag 2CO3 = [Ag +] 2 . [CO3 2-]
8 . 10 -12 = (2s) 2 (s)
8 . 10 -12 = 4 s 3
b. AgCl Ag + + Cl -
Ksp AgCl = [Ag +] = [Ag +] [Cl -]
2 . 10 -10 = s . s
2 . 10 -10 = s²
c. Ag 3PO4 3 Ag + + PO4 3-
Ksp Ag 3PO4 = [Ag +] 3 [PO4 3-]
1 . 10 -16 = (3s) 3 . s
1 . 10 -16 = 27 s 4
d. AgI Ag + + I -
Ksp AgI = [Ag +] [I -]
8,5 . 10 -17 = s . s
8,5 . 10 -17 = s²
e. AgCN Ag + + CN -
Ksp AgCN = [Ag +] [CN -]
1,2 . 10 -16 = s . s
1,2 . 10 -16 = s²
Jadi garam yang memiliki kelarutan paling besar adalah Ag 2CO3
16 . Berikut adalah data titik beku (Tf) berbagai larutan elektrolit dan non-elektrolit.
Berdasarkan data tersebut, dapat disimpulkan bahwa ........
A . larutan elektrolit yang berkonsentrasi sama memiliki titik beku yang sama
B . titik beku larutan dipengaruhi oleh jenis zat terlarut dan jenis pelarut
C . titik beku larutan elektrolit lebih tinggi daripada larutan non-elektrolit
D . semakin besar konsentrasi zat, semakin tinggi titik beku larutan
E . pada konsentrasi sama, titik beku larutan elektrolit lebih rendah daripada larutan
non-elektrolit
Kunci : E
Penyelesaian :
Berdasarkan data titik beku larutan elektrolit dan non-elektrolit :
Pada konsentrasi yang sama, titik beku larutan elektrolit lebih rendah
daripada larutan non-elektrolit (bandingkan antara NaCl, K2SO4
dengan gula, antara MgSO4 dengan Urea).
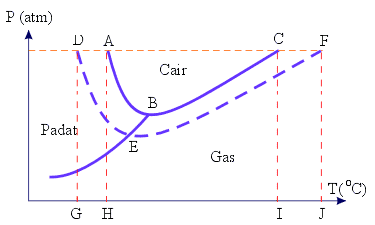
17 .
Dari diagram PT H 2O berikut yang merupakan daerah perubahan titik beku adalah ........
A . A dan H
B . B dan C
C . G dan H
D . I dan J
E . D dan E
Kunci : C
Penyelesaian :
Titik H adalah titik beku pelarut (H2O), yaitu 0°C
Titik G adalah titik beku larutan, yaitu < 0°C (negatif)
Jadi, daerah perubahan titik beku adalah G dan H.
18 . Diketahui data potensial elektroda standar :
Ag +(aq) + e - Ag (s) E° = +0,80 volt
Zn 2+(aq) + 2e Zn (s) E° = -0,76 volt
In 3+(aq) + 3e - In (s) E° = -0,34 volt
Mn 2+(aq) + 2e - Mn (s) E° = -1,20 volt
Reaksi redoks yang tidak berlangsung spontan adalah ........
A . Zn 2+(aq) + Mn (s) Mn 2+(aq) + Zn (s)
B . 3 Ag +(aq) + In (s) In 3+(aq) + 3 Ag (s)
C . 3 Mn (s) + 2 In 3+(aq) 2 In (s) + 3 Mn 2+(aq)
D . 2 I 3+(aq) + 3 Zn (s) 2 In (s) + 3 Zn 2+(aq)
E . Mn 2+(aq) + 2 Ag (s) Mn (s) + 2 Ag +(aq)
Kunci : E
Penyelesaian :
Agar reaksi dapat berlangsung spontan maka E° sel harus positif
- E° sel = E° red - E° oks
= E° Zn - E° Mn
= -0,76 - (-1,20)
= +0,44 V (spontan)
- E° sel = E° red - E° oks
= E° Ag - E° In
= 0,80 - (-0,34)
= + 1,14 V (spontan)
- E° sel = E° red - E° oks
= E° In - E° Mn
= -0,34 - (-1,20)
= +0,86 V (spontan)
- E° sel = E° red - E° oks
= E° In - E° Zn
= -0,34 - (-0,76)
= +0,42 V (spontan)
- E° sel = E° red - E° oks
= E° Mn - E° Ag
= -120 - 0,80
= -2 volt (tidak spontan)
19 .
Peristiwa elektrolisis dari keempat gambar di atas yang menghasilkan gas oksigen
adalah........
A . 1 dan 2
B . 1 dan 3
C . 3 dan 4
D . 2 dan 3
E . 2 dan 4
Kunci : B
Penyelesaian :
1. Elektrolisis larutan Na 2SO4 dengan elektroda C
Na 2SO4(aq) 2 Na +(aq) + SO4 2-(aq)
K (R) : 2 H2O(e) + 2e 2 OH - + H2(g)
A (O) : 2 H2O(l) 4 H + + O2(g) + 4e
2. Elektrolisis larutan NaCl dengan elektroda Pt dan C
K (R) : 2 H2O(1) + 2e 2 OH - + H2(g)
3. Elektrolisis larutan AgNO3 dengan elektroda Ag dan Pt
A (O) : 2 H2O(l) 4 H + + O2 (g) + 4e
4. Elektrolisis larutan MgCl 2 dengan elektroda C
MgCl 2(aq) Mg 2+(aq) + 2 Cl - (aq)
K (R) : 2 H2O(l) + 2e 2 OH - + H2(g)
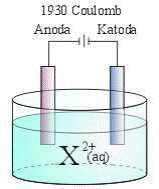
20 .
Dalam proses elektrolisis pada gambar di atas, arus listrik sebesar 1.930 coulomb
dilewatkan dalam leburan suatu zat elektrolit dan mengendapkan 1,5 gram X 2+ pada
katode. Jika diketahui tetapan Faraday adalah 96.500 coulomb, maka massa atom relatif
X adalah ........
A . 450
B . 300
C . 150
D . 75
E . 37,5
Kunci : C
Penyelesaian :
1930 Coulomb
21 . Sel elektrokimia :
Penulisan lambang sel yang tepat dari gambar sel tersebut adalah ........
A . Cu (a) | Cu 2+ || Zn (s) | Zn 2+(aq)
B . Zn (s) | Zn 2+(aq) || Cu 2+(aq) | Cu (s)
C . Cu 2+(s) | Cu (s) || Zn 2+(aq) | Zn (s)
D . Zn 2+(aq) | Zn (s) || Cu (s) | Cu 2+(aq)
E . Zn (s) | Zn 2+(aq) || Cu (s) | Cu 2+(aq)
Kunci : B
Penyelesaian :
Pada sel volta berlaku : KPAN (Katoda Positif, Anoda Negatif)
Zn sebagai anoda dan Cu sebagai katode
Penulisan diagram sel/lambang sel:
anode | larutan || larutan | katode
Zn (s) | Zn 2+(aq) || Cu 2+(aq) | Cu (s)
22 .
Besi paling cepat terkorosi pada percobaan nomor ........
A . (1)
B . (2)
C . (3)
D . (4)
E . (5)
Kunci : D
Penyelesaian :
Salah satu faktor yang dapat memperlambat korosi adalah dengan menempatkan logam
lain di sekitar besi yang harga E°-nya lebih kecil. (Misalnya: Zn, Al, Mg)
Pada wadah 1, 3 dan 5 logam Zn, Al dan Mg akan lebih dulu teroksidasi daripada besi.
Pada wadah 2 dan 4 , wadah 4 akan lebih cepat terkorosi dibandingkan dengan
wadah. 2, karena wadah 4 besi tidak terhalang oleh apapun, sehingga mudah terkorosi.
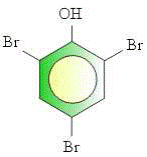
23 .
Nama senyawa dari struktur di atas adalah ........
A . tribromo fenol
B . 2, 3, 5-tribromo fenol
C . 2, 4, 6-tribromo fenol
D . 2, 3, 5-tribromo hidrokso benzene
E . 2, 4, 6-tribromo hidrokso benzene
Kunci : C
Penyelesaian :
2, 4, 6-tribromo fenol.
24 . Suatu senyawa karbon yang mengandung inti benzena mempunyai sifat sebagai berikut :
- berupa kristal dan larutan dalam air
- bersifat asam lemah dan bereaksi dengan NaOH
- bersifat pemusnah hama
Maka senyawa itu adalah ........
A . nitrobenzena
B . benzil alkohol
C . anilina
D . toluene
E . fenol
Kunci : E
Penyelesaian :
Sifat-sifat fenol :
- berupa kristal dan larut dalam air
- bersifat asam lemah dan bereaksi dengan NaOH
- bersifat pemusnah hama
25 . Perhatikan rumus bangun senyawa berikut :
(1) CH3 - CH2 - CH - CH3
|
CH - CH2 - CH3
|
CH3
CH3 CH3
| |
(2) CH - C - CH2 - CH3
| |
CH2 CH2
|
CH3
(3) CH2 - CH - CH - CH2
| | | |
CH3 CH3 CH3 CH3
(4) CH3 - CH - CH - CH2 - CH3
| |
CH2 CH2
| |
CH3 CH3
Pasangan senyawa yang merupakan isomer adalah ........
A . (2) dan (4)
B . (1) dan (2)
C . (3) dan (4)
D . (1), (2), dan (3)
E . (1), (2), (3), dan (4)
Kunci : A
Penyelesaian :
Isomer adalah rumus molekul sama, tetapi rumus strukturnya berbeda.
Dari rumus bangun tersebut, yang merupakan pasangan isomer adalah :
- (1) dan (3) yaitu C8H18
- (2) dan (4) yaitu C9H20
26 .
Polimer akrilik digunakan sebagai bahan dasar cat, sebagai monomer penyusunnya
adalah........
A .
B .
C .
E .
Kunci : A
Penyelesaian :
CH3 CH3 CH3
| | |
( - CH2 - C - CH2 - C - CH2 - C - )
| | |
COOCH3 COOCH3 COOCH3
Monomer dari rangkaian di atas adalah : CH2 = C - CH3
|
COOCH3
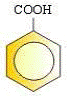
27 .
Aspirin dikenal juga dengan nama asetosal (asam asetil salisilat), memiliki khasiat sebagai
penghilang rasa sakit dan penurun panas, namun dalam penggunaan waktu lama
menimbulkan maag. Manakah rumus struktur aspirin tersebut dari struktur di bawah ini:
A .
B .
C .
D .
E .
Kunci : E
Penyelesaian :
O-Asetil Benzoat / Asam Asetil Salisilat atau biasa disebut Aspirin.
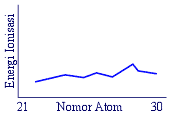
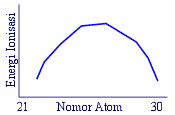
28 . Manakah satu di antara grafik berikut yang benar untuk menggambarkan energi ionisasi
tingkat pertama terhadap nomor atom dari unsur transisi periode keempat ........
A .
B .
C .
D .
E .
Kunci : D
Penyelesaian :
Dalam satu periode, energi ionisasi semakin ke kanan cenderung semakin besar.
29 .
Gambar di atas merupakan proses untuk mendapatkan asam sulfat dengan proses kontak.
Pada urutan ke berapa SO3 dan H2SO3 diperoleh ........
A . 1 dan 2
B . 1 dan 3
C . 2 dan 3
D . 2 dan 4
E . 3 dan 4
Kunci : C
Penyelesaian :
3. SO3(g) + H2SO4(l) H2S 2O7(l)
4. H2S 2 O7(l) + H2O(l) 2 H2SO4(l)
Maka asam sulfat terjadi pada reaksi 2 dan 3.
30 . Senyawa magnesium selain dipergunakan untuk penetralan asam lambung juga untuk batu
bata tahan api. Senyawa magnesium yang dipergunakan untuk batu bata tahan api
adalah........
A . MgSO4
B . Mg(OH) 2
C . MgCl 2
D . MgO
E . MS
Kunci : D
Penyelesaian :
MgSO4 digunakan sebagai obat urus-urus (MgSO4 7 H2O)
Mg(NH) 2 digunakan sebagai obat maag (lambung)
MgO digunakan untuk membuat untuk batu bata tahan api




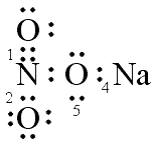



![clip_image020[1] clip_image020[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEja5OMa_tw2h527JCw5rxwNJvbfwGzVrHPCP1D4tZ4yhMXkIAOa3T3Ah1VmFEbc3TQ2s5nR35Wi7E5-hiNgoIA_yJHewDhGtEsO6vgAgyXlQa1eMM3pCJeGt_iDlqYCUUznjU7mPgM0B3U/?imgmax=800)










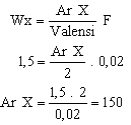



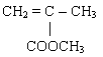
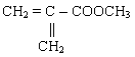







![clip_image103[1] clip_image103[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEibw5KjMxQ104l5OP4Dfa-n5p_EfaL8oiXw9Bnm_dvA987eADZw_ndokF9Yle0wRs373oi5nkV5B_jXM9Bhv1_PgRlkoO8EZDAy_YbSup9TI3t-LRh3wo1Vt9W_X1wh5Xfn26kcuX0QZdI/?imgmax=800)




![clip_image115[1] clip_image115[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhDbQFIB728q98J2vz7HgjpuR8Q7C4hxdCTiKQ04kXY_Y3EFUASzQFG4HuFCVrceX9p84xzUtcWKpcPysugXzjOOVy2xNcyIoTrEvTlgtCH79btqPMpOEnAeTmq8n7FzWioWUgcokspX3g/?imgmax=800)

0 Komentar untuk "Soal Ujian Nasional Kimia beserta Pembahasan bagian 1"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)