1. H2S dapat dioksidasi oleh KMnO4 menghasilkan antara lain K2SO4 dan MnO2. Dalam reaksi tersebut setiap mol H2S melepaskan ….
A. 2 mol elektron D. 7 mol elektron
B. 4 mol elektron E. 8 mol elektron
C. 5 mol elektron
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1988
Penyelesaian :
H2S K2SO4
4H2O + S-² SO42 + 8H+ + 8e
2. Di antara reaksi-reaksi tersebut di bawah ini yang merupakan contoh reaksi redoks adalah ….
A. AgNO3(aq) + NaCl(aq) AgCl(s) + NaNO3(aq)
B. 2KI(aq) + Cl2(aq) I2(s) + 2KCI(aq)
C. NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
D. NaOH(aq) + CH3COOH(aq) CH3COONa(aq) + H2O(l)
E. Al2O3(S) + 2NaOH(aq) 2NaAlO2(aq) + H2O(l)
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1989
Penyelesaian :
Reaksi redok adalah reaksi yang mengalami oksidasi (kenaikan bilangan oksidasi) dan reduksi (penurunan bilangan oksidasi).
3. Sebagian dari daur nitrogen di alam, adalah sebagai berikut Urutan bilangan oksidasi nitrogen dimulai dari N2, adalah ….
A. -3 ; 0 ; +1 ; +3 D. 0 ; 3 ; +4 ; +5
B. 0 ; +2 ; +4 ; 5 E. 0 , +1 ; +3 ; +5
C. -3 ; +1 ; +2 ; +3
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1989
Penyelesaian :
N2 bilangan oksidasinya 0
N O bilangan oksidasi N = +2
+2 -2
N O3 bilangan oksidasi N = +5
5 -6
N O2 bilangan oksidasinya N = +4
+4 -4
4. Reaksi-reaksi di bawah ini yang termasuk reaksi redoks adalah ….
A. AgCl (s) + 2NH3 (aq) Ag(NH3)2Cl (aq)
B. NaOH (aq) + CH3COOH (aq) CH3COONa (aq) + H2O (l)
C. AgNO3 (aq) + NaCl (aq) AgCl (s) + NaNO3 (aq)
D. OH- (aq) + Al(OH)3 (s) AlO2- (aq) + 2H2O(l)
E. Hg (NO3)2 (aq) + Sn (s) Hg (s) + Sn(NO3)2 (aq)
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
Ag NO3 (aq) + Na Cl (aq) Ag Cl (s) + Na NO3 (aq)
2 -2 1 -1 1 -1 1 -1
mengalami oksidasi
5. Reaksi berikut :
3Br (g) + a OH- (aq) b BrO3- + c Br- (aq) + d H2O (l)
Harga koefisien a, b, c, d supaya reaksi di atas setara adalah ….
A. 2, 2, 5 dan 1 D. 5, 6, 3 dan 1
B. 6, 1, 5 dan 3 E. 4, 1, 5 dan 2
C. 6, 5, 1 dan 3
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1990
Penyelesaian :
3Br (g) + 6 OH- (aq) 1 BrO3- + 5 Br- (aq) + 3 H2O (l)
a = 6 ; b = 1 ; c = 5 ; d = 3
6. Reaksi redoks :
2KMnO4 (aq) + 5H2C2O4 (aq) + 3H2SO4 (aq)
2MnO4 (aq) + 10 CO2 (g) + K2SO4 (aq) + 8H2O (l)
Setengah reaksi oksidasi dari reaksi tersebut adalah ….
A. MnO4-(aq) + 8 H+ (aq) + 5e Mn2+ (aq) + 4H2O (l)
B. MnO4-(aq) + 2H2O (l) + 3e MnO2 (s) + 4OH- (aq)
C. H2C2O4 (aq) 2CO2 (g) + 2H+ (aq) + 2e
D. CO2- (aq) + 2H+ (aq) + 2e H2C2O4 (aq)
E. 2H2SO4 (aq) 2H2O (l) + 2SO2 (g) + O2 (g)
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1991
Penyelesaian :
2KMnO4 (aq) + 5H2C2O4 (aq) + 3H2SO4 (aq)
2MnO4 (aq) + 10 CO2 (g) + K2SO4 (aq) + 8H2O (l)
Setengah reaksi redoks :
7. Reaksi redoks berikut :
a H2O2 (l) + b Fe2+ (aq) + c H+ (aq) d Fe3+ (aq) + e H2O (l)
Harga a, b, dari c berturut-turut ialah ….
A. 1,1,1 D. 2,2,1
B. 1,2,3 E. 2,1,2
C. 1,2,1
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1992
Penyelesaian :
8. Reaksi redoks yang sudah mengalami penyetaraan ialah ….
A. I2 (s) + S2O3 (aq) 2I- (aq) + SO42- (aq)
B. Al2O3 (s) + C (s) Al (s) + CO2 (g)
C. AgOH (s) + H+ (aq) Ag2+(aq) + H2O (l)
D. ClO- (aq) + Cl- (aq) + H+ (aq) H2O (l) + Cl2 (g)
E. MnO2(s) + 4H+ (aq) + 2Cl- (aq) Mn2+(aq) + 2H2O (l) + Cl2 (g)
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 1993
Penyelesaian :
MnO2 (s) + 4H+ (aq) + 2Cl- (aq) Mn2+ (aq) + 2H2O (l) + Cl2 (g)
Setara bila :
1. Jumlah muatan kiri = muatan kanan
2. Jumlah unsur sebelah kiri = jumlah unsur sebelah kanan.
9. Suatu unsur transisi memiliki konfigurasi elektron sebagai berikut :
1s22s22p63s23p63d54s2
Tingkat oksidasi tertinggi dari unsur tersebut adalah ….
A. +7 D. +3
B. +5 E. +2
C. +4
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1994
Penyelesaian :
Elektron terluar menentukan jumlah bilangan oksidasi.
10. Reaksi berikut yang merupakan redoks adalah ….
B. Cl2 + SO2 + H2O HCl + H2SO4
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1995
Penyelesaian :
Karena dalam reaksi tersebut mengalami reaksi reduksi dan oksidasi.
11. Suatu reaksi redoks :
aBr2 (aq) + bOH- (aq) cBrO3- (aq) + dBr- (aq) + eH2O (l)
Harga a, b, c dan a berturut-turut agar reaksi di atas setara adalah ….
A. 3, 6, 1, 5, 3 D. 6, 1, 3, 5, 3
B. 3, 6, 5, 1, 3 E. 1, 5, 3, 6, 3
C. 6, 1, 5, 3, 3
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1996
Penyelesaian :
3Br2 (aq) + 6OH- (aq) 1BrO3- (aq) + 5Br- (aq) + 3H2O (l)
12. Pada persamaan oksidasi reduksi berikut (belum setara),
KMnO4(aq) + KI(aq) + H2SO4 MnSO4(aq) + I2 aq) + K2SO4(aq) + H2O(l)
Bilangan oksidasi Mn berubah dari ….
A. +14 menjadi +8 D. -1 menjadi +2
B. +7 menjadi +2 E. -2 menjadi +2
C. +7 menjadi -4
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 1997
Penyelesaian :
KMnO4 = B.O K = +1
B.O Mn = x
B.O O = -2
1 + x - 8 = O x = +7
MnSO4 = Mn B.O = +2
13. Pada reaksi :
4HCl (aq) + 2S2O3-2 (aq) 2S (s) + 2SO2 (g) + 2H2O (l) + 4Cl- (aq)
bilangan oksidasi S berubah dari ….
A. +2 menjadi 0 dan +4 D. +5 menjadi +2 dan 0
B. +3 menjadi 0 dan +4 E. +6 menjadi -2 dan +4
C. +4 menjadi 0 dan +2
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1998
Penyelesaian :
14. Bilangan oksidasi klor dalam senyawa natrium hipoklorit, kalium klorit dan kalium klorat berturut-turut adalah ….
A. +3 +5 +7 D. -1 +3 +5
B. +1 +5 +7 E. -1 +1 +3
C. +1 +3 +5
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1998
Penyelesaian :
Natrium hipoklorit, Kalium klorit, Kalium klorat.
15. Perhatikan persamaan reaksi :
K2Cr2O, (s) + 14HCl (aq) 2KCl(aq) + 2CrCl3 (aq) + 3Cl2 (g) + 7H2O(l).
Unsur-unsur yang mengalami perubahan bilangan oksidasi pada persamaan reaksi tersebut adalah ….
A. Cr dan Cl D. H dan O
B. K dan Cl E. O dan Cl
C. Cr dan H
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 1999
Penyelesaian :
Cr dan Cl
16. Bilangan oksidasi Br tertinggi terdapat pada senyawa ….
A. Fe(BrO2)3 D. AlBr3
B. Ca(BrO)2 E. PbBr4
C. HBrO4
Jawaban : C
SMU/Ebtanas/Kimia/Tahun 1999
Penyelesaian :
A. BrO2- x-4 = -1
x = 3
Bilangan oksidasi Br dalam BrO2- = +3
B. BrO- x - 2 = -1
x = +1
Bilangan oksidasi Br dalam BrO- = +1
C. BrO4- x - 8 = -1 x = +7
Bilangan oksidasi Br dalam BrO4- = +7
D. Br- x = -1
Bilangan oksidasi Br dalam Br- = -1
E. PbBr4 - x = -1 Bilangan oksidasi Br dalam PbBr4- = -1
17. Bilangan oksidasi atom Cl tertinggi di antara senyawa berikut adalah ….
A. KCl D. KClO3
B. KclO E. KClO2
C. CaO2
Jawaban : D
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Bilangan oksida Cl dalam :
- KCl = -1
- KClO3= +5
- KClO = +1
- KClO2= +3
- CaCl2= -1
18. Perhatikan reaksi redoks :
Setelah reaksi disetarakan, perbandingan, banyak mol ion dengan
dalam reaksi tersebut adalah ….
A. 1 : 3 D. 3 : 2
B. 3 : 1 E. 1 : 6
C. 2 : 3
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 2000
Penyelesaian :
Perbandingan mol dengan
adalah 1 : 3
19. Persamaan reaksi berikut :
Mempunyai harga a, b, c, d berturut-turut ….
A. a = 14, b = 6, c = 2 d = 7
B. a = 6, b = 14, c = 2 d = 7
C. a = 6, b = 14, c = 1 d = 7
D. a = 2, b = 2, c = 5 d = 3
E. a = 3, b = 5, c = 1 d = 2
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 2001
Penyelesaian :
20. Di antara persamaan reaksi berikut, yang merupakan reaksi redoks adalah ….
A. NaOH (s) + HCl (aq) NaCl (aq) + H2O (l)
B. CaSO4 (aq) + 2 LiOH (aq) Ca(OH)2 (s) + Li2SO4 (aq)
C. Mg(OH)2 (s) + 2 HCl (aq) MgCl2 (aq) + 2 H2O (1)
D. BaCl12 (aq) + H2SO4 (aq) BaSO4 (s) + 2 HCl (aq)
E. MnO2 (s) + 4 HCl (aq) MnCl2 (aq) + 2 H2O (1) + Cl2 (g)
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 2002
Penyelesaian :
Yang merupakan reaksi redoks :
MnO2 (s) + 4 HCl (aq) MnCl2 (aq) + 2 H2O (1) + Cl2 (g)
21. Suatu reaksi redoks :
a Br2 (aq) + b OH- (aq) c BrO3- (aq) + d Br- (aq) + e H2O (1)
Harga a, b, c, d, dan e berturut-turut agar reaksi di atas setara adalah ….
A. 3, 6, 1, 5, dan 3 D. 6, 1, 3, 5, dan 3
B. 3, 6, 5, 1, dan 3 E. 1, 5, 3, 6, dan 3
C. 6, 1, 5, 3, dan 3
Jawaban : A
SMU/Ebtanas/Kimia/Tahun 2002
Penyelesaian :
a Br2 (aq) + b OH- (aq) c BrO3- (aq) + d Br- (aq) + e H2O (1)
Persamaan setaranya :
3 Br2 (aq) + 6 OH- (aq) BrO3- (aq) + 5 Br- (aq) + 3 H2O (1)
Jadi a = 3, b = 6, c = 1, d = 5 dan e = 3.
22. Diketahui persamaan reaksi redoks :
Cr2O72- (aq) + a Fe2+ (aq) + H (aq) b Cr3+ (aq) + c Fe3+ (aq) + H2O (1)
Jika persamaan reaksi disetarakan, harga koefisien a, b dan c masing-masing adalah ….
A. 6, 3 dan 6 D. 3, 4 dan 3
B. 6, 2 dan 6 E. 3, 2 dan 3
C. 4, 3 dan 5
Jawaban : B
SMU/Ebtanas/Kimia/Tahun 2002
Penyelesaian :
Cr2O72- (aq) + a Fe2+ (aq) + H (aq) b Cr3+ (aq) + c Fe3+ (aq) + H2O (1)
Disetarakan menjadi :
2 Cr2O72- (aq) + 6 Fe2+ (aq) + 14 H (aq) 2 Cr3+ (aq) + 6 Fe3+ (aq) + 7 H2O (1)
Jadi koefisien a = 6, b = 2, dan c = 6
23. Bilangan oksida Cl dari -1 sampai dengan +7. Ion atau molekul manakah di bawah ini yang tidak dapat mengalami reaksi disproporsionasi adalah ….
A. Cl2 dan HClO4 D. Cl2 dan KClO3
B. HCl dan HClO2 E. Cl- dan NaClO4
C. ClO2 dan HClO3
Jawaban : E
SMU/Ebtanas/Kimia/Tahun 2003
Penyelesaian :
Disproporsionasi atau auto redoks, Clor, Br dan I dapat mengalami auto redoks, artinya sebagian dioksidasi, sebagian lagi direduksi. Cl, Br dan I dapat memiliki Bilangan oksidasi dari -1 sampai dengan +7.
Yang memiliki bilangan oksidasi -1 atau +7 tidak dapat mengalami auto redoks karena bilangan oksidasi -1 tidak dapat direduksi lagi dan bilangan oksidasi +7 tidak.dapat dioksidasi lagi.
Jadi pasangan ion atau molekul yang tidak dapat mengalami auto redoks adalah Cl dan NaClO4.



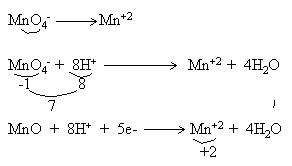


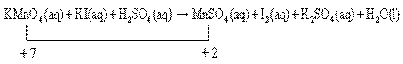


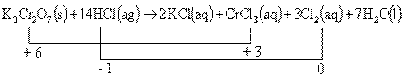

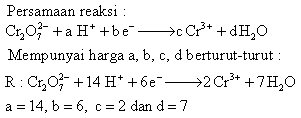

0 Komentar untuk "Soal dan Pembahasan Reaksi Reduksi dan Oksidasi"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)