· Laju reaksi dapat diartikan sebagai perubahan mol zat per liter dalam satuan waktu.
Dari persamaan reaksi untuk reaksi :
A ¾® B
Jika laju reaksi berbanding lurus dengan konsentrasi A, maka laju dapat dinyatakan sebagai :
Jika laju reaksi sebanding dengan kuadrat dari konsentrasi A.
dengan persamaan laju reaksi sebagai :
Laju = v = k [A]n
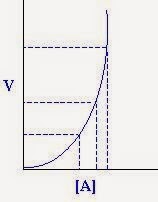
Dengan n merupakan orde reaksi, tampak orde reaksi merupakan pangkat dari konsentrasi, maka grafik yang akan diperoleh jika kita plot antara laju reaksi dan perubahan konsentrasi, adalah sebagai berikut :
a. Orde nol Laju = v = k [A]0 = k
b. Orde Satu Laju = v = k [A]1 = k [A]
c. Orde dua Laju = v = k [A]2
Untuk reaksi : A + B → hasil reaksi , maka :
Contoh soal :
Pada temperatur 273°C, gas brom dapat bereaksi dengan nitrogen monoksida menurut persamaan reaksi:
2NO(g) + Br2(g) ¾® 2NOBr(g)
Data hasil eksperimen dari reaksi itu adalah sebagai berikut:
|
Percobaan | Konsentrasi | Laju reaksi (mol L-1s-1) | |
| NO (mol L-1) | Br2 mol L-1 | ||
| 1 2 3 4 5 | 0,1 0,1 0,1 0,2 0,3 | 0,05 0,10 0,20 0,05 0,05 | 6 12 24 24 54 |
Tentukan: a. Orde reaksi terhadap NO
b. Orde reaksi terhadap Br2
c. Orde reaksi total
d. Tetapan laju reaksi (k)
e. Persamaan laju reaksinya
Contoh soal 2 :
diketahui data sebagai berikut :
| No Percobaan | [NO] awal (M) | [H2] awal (M) | Waktu (s) |
| 1. | 0,1 | 0,1 | 24 |
| 2. | 0,1 | 0,2 | 12 |
| 3. | 0,2 | 0,1 | 6 |
Tentukanlah Orde reaksi
Contoh soal 3 :
|
| Percobaan | [NH3] (M) | [O2] (M) | Laju (M/detik) |
|
| 1. | 0,1 | 0,3 | 6,0 x 10-3 |
|
| 2. | 0,2 | 0,4 | 1,6 x 10-2 |
|
| 3. | 0,5 | 0,5 | 5,0 x 10-2 |
|
| 4. | 0,4 | 0,6 | 4,8 x 10-2 |
|
| 5. | 0,3 | 0,9 | 5,4 x 10-2 |
Untuk reaksi : 4 NH3(g) + 5 O2(g) ¾® 4NO (g) + 6H2O(g)
Berdasarkan data tentukan persamaan laju reaksinya
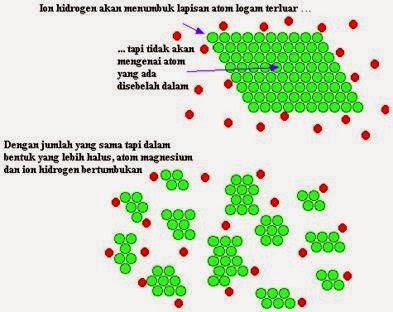
· Beberapa faktor yang mempengaruhi laju reaksi yaitu konsentrasi, luas permukaan, suhu dan penambahan katalis
· Konsentrasi
· Luas permukaan
· Suhu
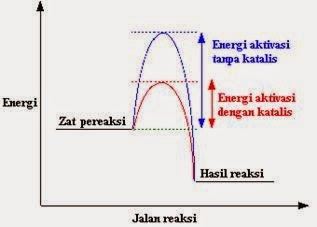
· Tumbukan akan menghasilkan hasil reaksi jika partikel yang bertumbukan memiliki energi yang cukup untuk melakukannya. Energi minimum ini disebut sebagai energi aktivasi untuk bereaksi. Hal itu digambarkan sebagai berikut
· Untuk mempercepat reaksi, kamu harus meningkatkan jumlah partikel dengan energi yang cukup untuk bereaksi, sebesar energi aktivasi atau lebih besar.
· Dengan kenaikan suhu kanan maka partikel yang memiliki energi kinetik yang tinggi semakin bertambah
· Hal ini terjadi karena meningkatkan suhu berarti meningkatkan reaksi yang disebabkan oleh peningkatan energi partikel yang tinggi untuk bertumbukan
· Katalis adalah zat yang dapat mempercepat suatu reaksi, tetapi secara kimia zat tersebut tidak berubah dan kita dapat memperoleh kembali ada akhir reaksi bahkan dengan jumlah massa yang sama
| Reaksi | Katalis |
| Penguraian hidrogen peroksida | Mangan(IV)oksida, MnO2 |
| Nitrasi benzen | Asam sulfat pekat |
| Pembuatan ammonia dalam proses Haber | Besi |
| Pengubahan dari SO2 menjadi SO3 selama proses kontak dalam pembuatan asam sulfat terjadi. | Vanadium(V)oksida, V2O5 |
| Hidrogenasi ikatan rangkap C=C | Nikel |
· Contoh untuk reaksi pembentukan CH3CH2Cl berikut:
akan lebih efektif dan energi aktivasinya lebih rendah dibandingkan denga jika bertumbukan dengan araj orientasi seperti berikut:
Dengan kata lain untuk mengerakkkan energi aktivasi dalam gambar sebagai berikut :
· Penambahan katalis memiliki pengaruh pada energi aktivasi. Sebuah katalis memberikan jalan reaksi yang lain dengan energi aktivasi lebih rendah. Seperti ditunjukkan dalam gambar berikut
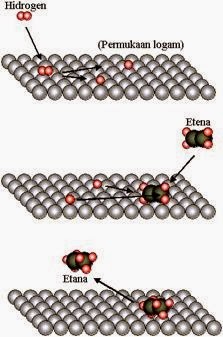
· Contoh reaksi pemutusan ikatan rangkap pada etena untuk membentuk etana yang sangat sulit dilakukan dapat dilakukan dengan menempuh cara lain jika ada katalis logam nikel
· Dalam tubuh mahluk hidup sudah tersedia katalis tertentu untuk mempercepat reaksi yang biasanya merupakan suatu enzym, seperti enzym yang membantu proses pencernaan
· Pembuatan amoniak di industri dilakukan melalui proses Haber















1 Komentar untuk "Persamaan laju Reaksi dan Orde Reaksi"
jawaban contoh soal pertama mana?? kok nggak ada ??
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)