· Berdasarkan hukum Hess kita bisa menentukan perubahan entalpi suatu reaksi dengan melihat data entalpi reaksi yang lain, data entalpi yang menjadi dasar penentuan tersebut adalah data perubahan entalpi pembentukan standar.
· Entalpi pembentukan stangar merupakam entalpi reaksi pembentukan suatu senyawa yang diukur pada tekanan 1 atm, suhu 25oC. Jika kita memiliki reaksi seperti :
a W + b X ¾® c Y + d Z
maka berdasarkan perhitungan perubahan entalpi reaksi adalah :
DHreaksi = DH(hasil reaksi) - DH(zat pereaksi)
menjadi : DHreaksi = (c x DHf Y + d x DHf Z ) - (a x DHf W + b x DHf X )
Apakah benar seperti itu? Mari kita buktikan bersama. Kita mengetahui
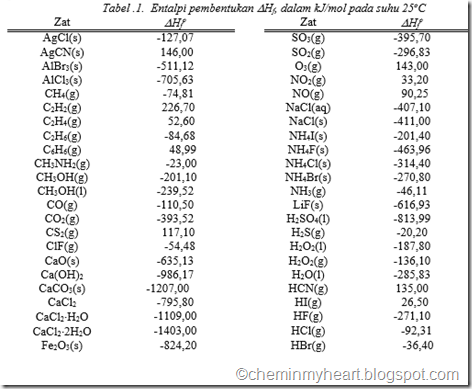
sedangkan DHf CO = -110,5 kJ/mol dan DHf CO2 = -393,52 kJ/mol
jika pernyataan diatas benar maka
karena, oksigen merupakan unsur maka DHf O2 = 0.
hanya terjadi sedikit perbedaan, yang menunjukkan cara ini cukup akurat untuk digunakan dalam penentuan DH suatu reaksi.
Contoh soal :
DHf CO = -110,5 kJ/mol DHf CH3OH = -239,0 kJ/mol
Tentukanlah perubahan entalpi reaksi antara karbon monoksida (CO) dan hidrogen (H2) untuk membentuk metanol (CH3OH).
Jawab :
Persamaan reaksinya adalah : CO(g) + 2H2(g) ¾® CH3OH(l)
Maka : DHreaksi = (1 x DHf CH3OH) – (1 xDHf CO + 2 x DHf H2)
= (1 x –239,0 kJ/mol) – (1 x –110,5 kJ/mol + 2 x 0)
= -239,0 kJ/mol + 110,5 kJ/mol = -128,5 kJ/mol
DHf H2 bernilai nol karena H2 merupakan unsur.

![clip_image006[4] clip_image006[4]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj-6Izo0vWyW0mO68vSndJ0tpCeidg4r3ZItuWmevj6_bE-W6afrZ4vC_ZZGZi0a-iCXytvebZp9A0x2gmh819yEwFmsIl2mMGT-R8hF3zwUsTXKecj2ec5xZ5r2lgPc7aO4HDqiKDonEY/?imgmax=800)

0 Komentar untuk "Penentuan DH Reaksi dan DH Pembentukan Standar"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)