Soal no. 1
Perhatikan grafik titik didih senyawa-senyawa hidrida golongan IVA, VA, dan VIA berikut!
Senyawa yang mempunyai ikatan hidrogen antar molekulnya adalah nomor….
A. 1 dan 2
B. 2 dan 3
C. 2 dan 4
D. 4 dan 5
E. 5 dan 6
Pembahasan
Senyawa yang memiliki ikatan hidrogen antar molekulnya memiliki ciri titik didihnya tinggi.
Dari grafik yang 3 dan 2 memiliki titik didih relatif tinggi.
Jawab: B.
Soal no. 2
Perhatikan data sifat fisik dari dua zat berikut!
Jenis ikatan yang terdapat pada zat X dan zat Y berturut-turut adalah….
A. ionik dan kovalen nonpolar
B. kovalen nonpolar dan ionik
C. kovalen polar dan kovalen nonpolar
D. kovalen polar dan ionik
E. hidrogen dan ionik
Pembahasan
Ciri-ciri ikatan Kovalen polar:
-titik leleh rendah
-bentuk larutannya dapat menghantarkan listrik
-bentuk lelehannya tidak dapat menghantar listrik
Ciri-ciri ikatan Kovalen nonpolar:
-titik leleh rendah
-bentuk larutannya tidak dapat menghantarkan listrik
-bentuk lelehannya tidak dapat menghantarkan listrik
Ciri-ciri ikatan Ionik:
-titik lelehnya tinggi
-bentuk larutannya dapat menghantarkan listrik
-bentuk lelehannya dapat menghantarkan listrik
Dari ciri-cirinya jenis ikatan pada X dan Y masing-masing adalah ionik dan kovalen nonpolar.
Jawab: A.
Soal no. 3
Diketahui konfigurasi elektron: Si = [Ne] 3s2 3p2
F = [He] 2s2 2p5
Jika kedua unsur tersebut membentuk senyawa, bentuk molekul yang terjadi sesuai aturan oktet adalah….
A. linear
B. segitiga datar
C. tetrahedral
D. segitiga piramida
E. oktahedral
Pembahasan
Si = [Ne] 3s2 3p2 → elektron valensinya 4
F = [He] 2s2 2p5 → elektron valensinya 7
F (elektron valensi 7) jadi perlu 1 elektron lagi agar mencapai kesetimbangan oktet, sementara Si menyumbang 4 elektron untuk dipakai bersama.
Molekul yang terbentuk SiF4 (silicon tetrafluoride), bentuk molekul tetrahedron (tipe AX4)
Jawab: C
Soal no. 4
Perhatikan notasi unsur berikut!
Letak unsur dan konfigurasi elektron yang paling tepat untuk unsur A adalah…… (Nomor atom Ar = 18)
Pembahasan

Konfigurasi elektron dari A
1s2 2s2 2p6 3s2 3p6 4s2 3d3
= [Ar] 4s2 3d3
Banyaknya kulit n = 4 → Periode 4
Elektron valensi 4s2 3d3 → ada 5, mengisi sub kulit s dan d, termasuk unsur transisi, Golongan VB.
Jawab: E.
Soal no. 5
Harga keempat bilangan kuantum elektron terakhir dari unsur
adalah…
A. n = 3; l = 1; m = - 1; s = – ½
B. n = 3; l = 2; m = +2; s = + ½
C. n = 3; l = 1; m = 0; s = + ½
D. n = 3; l = 2; m = - 2; s = + ½
E. n = 3; l = 2; m = 0; s = +½
Pembahasan
Konfigurasi elektron dari 25Mn55
1s2 2s2 2p6 3s2 3p6 4s2 3d5
dari 3d5
n = 3 (kulit ke-3)
l = 2 (subkulit d, l = 2) m = + 2 (letak orbital) s = + ½ (arah spin)
Jawab: B
Soal no. 6
Perhatikan gambar struktur Lewis senyawa asam nitrat (HNO3) berikut!
Pasangan elektron yang terbentuk secara kovalen koordinasi ditunjukkan oleh nomor….
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan
Ikatan kovalen koordinat adalah ikatan kovalen dimana pasangan elektron yang digunakan
bersama berasal dari satu atom saja. Pasangan elektron nomor 3 adalah pasangan elektron koordinasi.
Jawab: C
Soal no. 7
Aluminium larut dalam larutan asam sulfat menghasilkan larutan aluminium sulfat dan gas
hidrogen. Persamaan reaksi yang tepat pada peristiwa tersebut adalah…
A. 2Al (s) + 3H2 SO4 (aq) → Al2(SO4)3 (aq) + 3H2 (g)
B. Al (s) + H2SO4 (aq) → Al2(SO4)3 (aq) + H2 (g)
C. 2Al (s) + H2SO4 (aq) → Al2(SO4)3 (aq) + 3H2 (g)
D. Al (s) + 3H2SO4 (aq) → Al2(SO4)3 (aq) + 3H2 (g)
E. 2Al (s) + 3H2SO4 (aq) → 2Al2(SO4)3 (aq) + 3H2 (g)
Pembahasan
Reaksi yang setara memiliki jumlah masing-masing atom di ruas kiri sama dengan ruas
kanan.
2Al (s) + 3H2 SO4 (aq) → Al2(SO4)3 (aq) + 3H2 (g) Al = 2
H = 6
S = 3
O = 12
Jawab : A.
Soal no. 8
Sebanyak 11,6 gram senyawa hidrat Na2SO4 ⋅ x H2O dipanaskan sampai terbentuk Na2SO4
sebanyak 7,1 gram menurut reaksi
Na2SO4 ⋅ xH2O(s) → Na2SO4(s) +xH2O(g).
Jika Ar Na = 23; S = 32 dan H = 1, rumus senyawa kristal tersebut adalah…
A. Na2SO4 ⋅ H2O
B. Na2SO4 ⋅ 2H2O
C. Na2SO4 ⋅ 3H2O
D. Na2SO4 ⋅ 4H2O
E. Na2SO4 ⋅ 5H2O
Pembahasan
Banyak mol Na2SO4 yang terbentuk adalah:
Reaksi:
Terlihat koefisien Na2SO4 ⋅ xH2O sama dengan koefisien Na2SO4 jadi yang bereaksi juga
0,05 mol.
Sehingga dari massa dan mol Na2SO4⋅ xH2O ( Ar Na = 23; S = 32; O = 16; dan H = 1)
Jawab: E
Soal no. 9
Sebanyak 24,5 gram padatan kalium klorat dipanaskan dalam wadah tertutup, sehingga
terjadi reaksi sesuai persamaan:
2 KClO3 (s) → 2KCl (s) +3O2 (g) Massa zat yang dihasilkan adalah….
(Ar: K = 39; Cl = 35,5; O = 16)
A. 122,5 gram
B. 61,2 gram
C. 24,5 gram
D. 14,9 gram
E. 9,6 gram
Pembahasan
Zat yang dihasilkan pada soal di atas adalah adalah zat yang di ruas kanan yaitu KCl
sekaligus O2. Massa sebelum dan sesudah reaksi di sini akan sama, 24,5 gram.
Jawab : C.
atau bisa juga dengan perhitungan:
mol KClO3 yang bereaksi sebanyak
Reaksi yang terjadi
KCl yang dihasilkan 0,2 mol dan O2 sebanyak 0,3 mol, massa masing-masing zat adalah:
Massa zat yang dihasilkan dengan demikian adalah :
14,9 + 9,6 = 24,5 gram
Jawab: C
Soal no. 10
Perhatikan data percobaan uji larutan berikut!
Pasangan senyawa yang merupakan larutan elektrolit kuat dan nonelektrolit berturut-turut ditunjukkan oleh larutan nomor….
A. (1) dan (2)
B. (2) dan (5)
C. (4) dan (5)
D. (5) dan (1)
E. (5) dan (3)
Pembahasan
Ciri-ciri larutan elektrolit kuat diantaranya:
- Lampu terang atau redup .
- banyak gelembung gas di elektrodanya.
Ciri-ciri larutan elektrolit kuat diantaranya:
- Lampu mati
- Tidak ada gelembung gas di elektrodanya
Larutan elektrolit kuat nomor 5, sementara non elektrolit nomor 1.
Jawab : D.
Ciri-ciri larutan-daya hantar
Soal no. 11
Berikut ini beberapa contoh penggunaan sifat koligatif larutan dalam kehidupan sehari-hari:
1) penggunaan glikol pada radiator mobil;
2) menghilangkan salju di jalan raya dengan menggunakan garam dapur atau urea;
3) penggunaan cairan obat tetes mata;
4) memisahkan zat beracun dalam air limbah sebelum dilepas ke lingkungan bebas; dan
5) naiknya zat makanan dari akar tanaman ke daun/batang.
Penerapan dari penurunan titik beku larutan terdapat pada nomor….
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
Pembahasan
1) penggunaan glikol pada radiator mobil → penurunan titik beku.
2) menghilangkan salju di jalan raya dengan menggunakan garam dapur atau urea →
penurunan titik beku.
3) penggunaan cairan obat tetes mata → osmosis.
4) memisahkan zat beracun dalam air limbah sebelum dilepas ke lingkungan bebas →
osmosis balik.
5) naiknya zat makanan dari akar tanaman ke daun/batang.
Penurunan titik beku larutan
Kunci jawaban: A
Soal no. 12
Perhatikan gambar berikut!
terdapat pada nomor 1 dan 2.
Larutan yang memiliki tekanan uap paling kecil terdapat pada gambar nomor….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Tekanan uap paling kecil saat partikel dari zat terlarutnya paling banyak. Dari gambar yang
paling banyak memiliki partikel zat terlarut adalah gambar nomor 5.
Kunci jawaban : E
Soal no. 13
Perhatikan data uji pH beberapa larutan!
Larutan yang merupakan larutan penyangga adalah….
A. P dan Q
B. Q dan R
C. R dan S
D. R dan T
E. S dan T
Pembahasan
Cirinya larutan penyangga jika ditambah sedikit asam atau ditambah sedikit basa perubahan
pH nya relatif kecil. Q dan R termasuk larutan penyangga (buffer).
Kunci jawaban: B
Soal no. 14
Sebanyak 100 mL KOH 0,04 M dicampur dengan 100 mL HCOOH 0,04 M menurut reaksi:
KOH (aq) + HCOOH (aq) → HCOOK (aq) + H2O (l)
Jika Ka HCOOH = 2 × 10–4 dan Kw = 10–14 , pH campuran tersebut sebesar….
A. 8 + log √2
B. 8 + log 1
C. 6 − log 1
D. 6 − log √2
E. 2 − log 6
Pembahasan
Data:
100 mL KOH 0,04 M → 4 mmol
100 mL HCOOH 0,04 M → 4 mmol
KOH dan HCOOH akan habis bereaksi, terbentuk garam HCOOK sebanyak 4 mmol. Volume total larutan 100 + 100 = 200 mL
[HCOOK] = 4 mmol/200 mL = 0,02 M = 2 × 10−2
Hidrolisis garam:
Jawab: B.
Soal no. 15
Penerapan sifat-sifat koloid dalam kehidupan sehari-hari antara lain:
(1) pembentukan delta di muara sungai; (2) proses cuci darah;
(3) penggumpalan lateks;
(4) penggunaan norit untuk obat sakit perut; dan
(5) sorot lampu bioskop pada udara berasap.
Contoh penerapan sifat koloid yang merupakan sifat koagulasi adalah nomor…
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (4) dan (5)
Pembahasan
Kimia koloid. Dari option yang ada:
(1) pembentukan delta di muara sungai; → koagulasi
(2) proses cuci darah; → dialisis
(3) penggumpalan lateks; → koagulasi
(4) penggunaan norit untuk obat sakit perut; → adsorpsi
(5) sorot lampu bioskop pada udara berasap → Efek Tyndall
Koagulasi nomor 1 dan 3.
Kunci Jawaban : B
Soal no. 16
Untuk menetralkan konsentrasi larutan HCl, diambil 20 mL larutan tersebut kemudian
dititrasi dengan larutan Ba(OH)2 0,1 M. Data titrasi yang diperoleh sebagai berikut:
Berdasarkan data tersebut, konsentrasi HCl sebesar…. A. 0,060 M
B. 0,065 M C. 0,070 M D. 0,130 M E. 0,200 M
Pembahasan Titrasi asam basa: Data:
Basa Ba(OH)2 0,1 M M = 0,1
V = (12 + 13 + 14) : 3 = 13 mL
n = 2
Asam HCl 20 mL V = 20 mL
n = 1
M =....
Kunci jawaban: D. 0,130 M
Soal no. 17
Sebanyak 100 mL Ca(OH)2 0,02 M memiliki harga pH sebesar….
A. 2 − log 4
B. 2 + log 4
C. 12 − log 4
D. 12 + log 2
E. 12 + log 4
Pembahasan
Data:
100 mL Ca(OH)2 0,02 M → 2 mmol
Ca(OH)2 → Ca2+ + 2OH −
2 mmol 2 mmol 4 mmol
Konsentrasi OH −, pOH dan pH larutannya adalah:
Kunci = E. 12 + log 4
Soal no. 18
Sebanyak 50 mL larutan Ca(NO3)2 10−2 M dicampurkan dengan 50 mL larutan Na2CO3 10−2
M dengan reaksi:
Ca(NO3)2 (aq) + Na2CO3 (aq) → CaCO3 (s) + 2NaNO3 (aq)
Jika Ksp CaCO3 = 9 × 10−9, massa yang mengendap sebanyak… (Ar Ca = 40; C = 12; O = 16; Na = 23; N = 14)
A. 100 gram
B. 0,100 gram
C. 0,050 gram
D. 0,025 gram
E. 0,0025 gram
Soal no. 19
Beberapa manfaat makanan dalam tubuh di antaranya:
(1) sebagai bio katalis;
(2) pelarut vitamin-vitamin yang sukar larut dalam air; (3) pengangkut oksigen; dan
(4) sumber energi utama.
Pernyataan yang merupakan manfaat protein adalah nomor…
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Manfaat protein diantaranya adalah:
a) sebagai biokatalis
b) pengangkut oksigen / protein transpor
c) sebagai zat pembangun
d) sebagai penyimpan atau cadangan makanan
e) berperan dalam sistem gerak makhluk hidup
f) untuk kesehatan tubuh berfungsi sebagai antibodi atau pelindung
g) sebagai pengatur aktivitas seluler
Kunci jawaban: B. 1 dan 3
Soal no. 20
Beberapa kegunaan senyawa karbon sebagai berikut:
(1) pengawet mayat;
(2) penyedap rasa;
(3) bahan dasar plastik;
(4) pemberi aroma; dan
(5) obat bius.
Kegunaan dari formaldehida ditunjukkan pada nomor….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Kegunaan formaldehida diantaranya:
- untuk pengawet mayat, biasa digunakan formalin (larutan 40% formaldehida dalam air).
- untuk membuat plastik jenis termoset yaitu plastik yang tahan panas.
Sementara itu untuk obat bius (anestesi) biasa digunakan eter juga haloalkana (kloroform, kloroetana), siklopropana dan halotan. Untuk pemberi aroma (essen) banyak digunakan ester, sedangkan penyedap rasa menggunakan sodium glutamat (MSG) yang merupakan garam natrium dari asam glutamat.
Jawab: B. 1 dan 3
Soal no. 21
Perhatikan persamaan reaksi berikut!
I. CH2 = CH2 + Br2 → CH2 Br − CH2Br
II. CH3 − CH2 − CH2Cl + NaOH → CH3 − CH = CH2 + NaCl + H2O
Jenis reaksi yang terjadi pada persamaan reaksi I dan II berturut-turut adalah….
A. adisi dan substitusi
B. adisi dan eliminasi
C. substitusi dan eliminasi
D. eliminasi dan adisi
E. eliminasi dan substitusi
Pembahasan
Pada reaksi I
CH2 = CH2 + Br2 → CH2 Br − CH2Br
Ikatan rangkapnya hilang (terjadi pemutusan ikatan rangkap), dan penambahan zat lain (Br)
→ Reaksi Adisi
Pada reaksi II
CH3 − CH2 − CH2Cl + NaOH → CH3 − CH = CH2 + NaCl + H2O Terjadi pembentukan ikatan rangkap → Reaksi eliminasi
Jawab: B. adisi dan eliminasi
Soal no. 22
Suatu zat berumus molekul CnH2nO bila direaksikan dengan Fehling tidak membentuk endapan merah bata. Zat tersebut mengandung gugus fungsi….
Pembahasan
Senyawa keton tidak membentuk endapan merah bata jika direaksikan dengan pereaksi
Fehling. Gugus fungsi keton ditunjukkan gambar D.
Jawab : D
Soal no. 23
Berikut tabel yang berisi data polimer, monomer, proses pembentukan, dan kegunaannya:
Pasangan data yang keempatnya berhubungan dengan tepat adalah…
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (5)
E. (4) dan (5)
Pembahasan
Polimer teflon berasal dari tetrafluoroetena yang dibuat dengan reaksi adisi. Sementara PVC
berasal dari vinilklorida dibuat dengan proses adisi.
Jawaban : B. 1 dan 3
Soal no. 24
Pasangan data yang berhubungan dengan tepat adalah…
Pembahasan
Sukrosa tidak menghasilkan endapan Cu2O saat direaksikan dengan Fehling.
Jawab : E.
Soal no. 25
Beberapa senyawa turunan benzena berikut:
(1) fenol;
(2) trinitrotoluena;
(3) stirena;dan
(4) asam benzoat.
Senyawa yang digunakan sebagai bahan baku pembuatan bahan peledak dan sebagai pengawet makanan atau minuman berturut-turut adalah nomor….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Bahan baku peledak → TNT, TNB
Pengawet makanan atau minuman → asam benzoat
Jawab : D. 2 dan 4
Soal no. 26
Perhatikan diagram tingkat energi berikut!
Berdasarkan diagram tersebut, harga ΔH sebesar….
A. +526 kJ
B. − 42 kJ
C. − 242 kJ
D. − 256 kJ
E. − 284 kJ
Pembahasan
Dari diagram terlihat bahwa untuk menguapkan 1 mol air H2O (l) → H2O (g) diperlukan kalor:
ΔH = − 284 −(−242) = − 284 + 242 = − 42 kJ
Jawab: B. − 42 kJ
Soal no. 27
Diketahui persamaan reaksi kimia:
Ca (s) + C (s) + 3/2 O2 (g) → CaCO3 (s) Δ H = − 1.207,5 kJ/mol
Grafik yang menunjukkan proses reaksi tersebut adalah….
E.
Pembahasan
Reaksi Ca (s) + C (s) + 3/2 O2 (g) → CaCO3 (s) Δ H = − 1.207,5 kJ/mol
Artinya:
Ca (s) + C (s) + 3/2 O2 (g) menjadi CaCO3 (s) ΔH nya sebesar minus 1.207,5 kJ/mol. Gambarnya seperti pada C.
Jawab:C
Soal no. 28
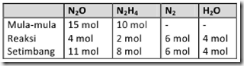
Reaksi kesetimbangan gas dinitrogen monoksida dengan hidrazin pada suhu 400° C dalamwadah 10 liter, adalah sebagai berikut:
Diperoleh data:
Harga Kc dari kesetimbangan tersebut adalah….
Pembahasan
Rumus tetapan kesetimbangan:
Jangan lupa membagi molnya dengan volum (10 liter) diperoleh:
Jawab: D
Soal no. 29
Pada reaksi kesetimbangan:
2NO (g) + O2 (g) ↔ N2O4 (g) ΔH = − a kJ
Jika suhu dinaikkan, yang terjadi adalah….
A. kesetimbangan akan bergeser ke kiri karena proses reaksi eksoterm
B. kesetimbangan akan ke kanan karena Δ H = −a kJ
C. laju reaksi ke kanan bertambah besar karena ΔH = −a kJ
D. kesetimbangan tetap karena koefisien pereaksi lebih besar
E. N2O4 bertambah karena koefisien lebih kecil
Pembahasan
Δ H reaksi bernilai negatif :
→ ke arah kanan reaksi tipe eksoterm.
← ke arah kiri reaksi tipe endoterm
Jika suhu dinaikkan, kesetimbangan bergeser ke arah reaksi endoterm (ke kiri)
Jawab: A. kesetimbangan akan bergeser ke kiri karena proses reaksi eksoterm (maksudnya reaksi pada soal di atas adalah reaksi eksoterm)
Soal no. 30
Gambar berikut merupakan reaksi antara 2 gram pualam dengan 100 mL HCl.
Laju reaksi yang hanya dipengaruhi oleh konsentrasi adalah nomor….
A. (1) terhadap (2)
B. (1) terhadap (3)
C. (2) terhadap (3)
D. (2) terhadap (4)
E. (4) terhadap (5)
Pembahasan
Dari pilihan yang ada dicari yang hanya berbeda di konsentrasinya:
A. (1), (2) → Luas permukaan beda.
B. (1), (3) → Suhu berbeda.
C. (2), (3) → Suhu dan luas permukaan berbeda.
D. (2), (4) → Konsentrasi berbeda.
E. (4), (5) → Suhu berbeda.
Jawab : D. 2 terhadap 4.
Soal no. 31
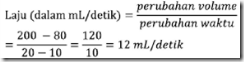
Perhatikan data laju reaksi pada suhu 25° C berikut!
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
Laju pembentukan gas H2 rata-rata pada suhu tersebut adalah….
A. 8,0 mL/detik
B. 10,5 mL/detik
C. 11,0 mL/detik
D. 11,5 mL/detik
E. 12,0 mL/detik
Pembahasan
Laju pembentukan gas H2, dari data pertama dan kedua:
atau dari data kolom pertama dan kolom ketiga:
Jawab: E. 12 mL/detik
Soal no. 32
Berikut ini adalah percobaan tentang korosi besi:
Paku yang paling cepat mengalami korosi terdapat pada gambar nomor….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Paku yang paling cepat mengalami perkaratan adalah paku nomor 3 yang dicelupkan ke
dalam air.
Jawab : C. (3)
Soal no. 33
Diketahui potensial reduksi standar sebagai berikut:
Fe2+ | Fe Eo = −0,41 V
Zn2+ | Zn Eo = −0,76 V
Cu2+ | Cu Eo = +0,34 V
Ag+ | Ag Eo = +0,80 V
Reaksi yang tidak dapat berlangsung spontan adalah….
A. Fe | Fe2+ || Zn2+| Zn
B. Zn | Zn2+ || Cu2+ | Cu
C. Fe | Fe2+ || Cu2+ | Cu
D. Cu | Cu2+ || Ag+ | Ag
E. Fe | Fe2+ || Ag+ | Ag
Pembahasan
Reaksi yang tidak dapat berlangsung spontan jika nilai Eosel nya bernilai NEGATIF.
Dari pilihan A:
Fe | Fe2+ || Zn2+| Zn
Fe → Fe2+ + 2e Eo = +0,41 V Zn2+ + 2e → Zn Eo = −0,76 V
Fe + Zn2+ → Fe2+ + Zn Eo = − 0,35 V
Jawab: A
Soal no. 34
Gas klorin dapat dibuat dengan mereaksikan larutan permanganat ke dalam larutan asam
klorida menurut reaksi berikut ini:
a KMnO4 (aq) + b HCl (aq) → c MnCl2 (aq) + d Cl2 (g ) + e H2O (l) + f KCl (aq)
Nilai koefisien b, c, dan d berturut-turut adalah….
A. 8, 5, dan 3
B. 10, 2, dan 5
C. 12, 4, dan 5
D. 14, 5, dan 2
E. 16, 2, dan 5
Pembahasan
Reaksi:
a KMnO4 + b HCl → c MnCl2 + d Cl2 + e H2O + f KCl
Dari KMnO4 dan KCl diperoleh a = f misalkan diberi koefisien awal dulu 4, jadi a = 4, f = 4. Persamaan di atas menjadi:
4 KMnO4 + b HCl → c MnCl2 + d Cl2 + e H2O + 4 KCl
Berikutnya, ke atom Mn dulu. Di kiri ada 4, jadi untuk sebelah kanan c = 4. Reaksi jadi:
4 KMnO4 + b HCl → 4 MnCl2 + d Cl2 + e H2O + 4 KCl
Lanjutkan atom O, sebelah kiri ada 16, agar kanan juga 16 maka e = 16.
4 KMnO4 + b HCl → 4 MnCl2 + d Cl2 + 16 H2O + 4 KCl
H di kanan ada 32, jadi b = 32
4 KMnO4 + 32 HCl → 4 MnCl2 + d Cl2 + 16 H2O + 4 KCl
Terakhir, Cl, di kiri ada 32, dikanan 8 + 2d + 4 = 32, d = 10. Diperoleh:
4 KMnO4 + 32 HCl → 4 MnCl2 + 10 Cl2 + 16 H2O + 4 KCl
Sederhanakan, bagi dua semua:
2 KMnO4 + 16 HCl → 2 MnCl2 + 5 Cl2 + 8 H2O + 2 KCl
Jadi b = 16, c = 2, d = 5.
Jawab: E. 16, 2, dan 5
Soal no. 35
Poses elektrolisis lelehan NaCl dengan elektrode karbon, digunakan arus sebesar 10 ampere
selama 30 menit. Massa logam natrium yang diperoleh adalah….
Pembahasan
Data:
i = 10 ampere
t = 30 menit = 30 x 60 detik
e = Ar Na / biloks = 23 / 1 = 23
Jawab : A
Soal no. 36
Perhatikan beberapa persamaan reaksi berikut ini!
|
+ 2e-
→ 2S2O32-
(2) Mg → Mg2+ + 2e-
(3) MnO2 → MnO4-
(4) 2CO2 + 2e- → C2O42-
Persamaan reaksi yang merupakan reaksi oksidasi terdapat pada nomor….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan
Pada reaksi oksidasi terjadi kenaikan biloks.
Jawab : B. 1 dan 3
Soal no. 37
Berikut ini beberapa nama pengolahan unsur:
(1) Tanur tinggi; (2) Down;
(3) Hall-Heroult; (4) Deacon;dan (5) Wohler.
Pengolahan fosfor terdapat pada nomor….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Nama-nama proses pengolahan senyawa atau unsur:
(1) Tanur tinggi → besi. (2) Down → magnesium
(3) Hall-Heroult → aluminium
(4) Deacon → klorin (5) Wohler → fosfor
Jawab: E. (5) Wohler
Soal no. 38
Beberapa senyawa golongan alkali tanah berikut:
(1) CaSO4 ⋅ 2H2O; (2) CaCO3;
(3) Mg(OH)2; (4) CaC2;dan (5) Sr(NO3)2
Senyawa yang digunakan untuk membalut bagian tubuh yang patah tulang adalah nomor….
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan
Gips atau CaSO4 ⋅ 2H2O digunakan untuk membalut bagian tubuh yang patah tulang.
CaCO3 adalah batu kapur, CaC2 kalsium karbida adalah karbit salah satunya untuk keperluan
pengelasan.
Mg(OH)2 : magnesium hidroksida sebagai bahan obat maag dan pasta gigi.
Jawab : A. 1
Soal no. 39
Beberapa sifat zat sebagai berikut:
(1) umumnya senyawanya berwarna;
(2) mengalami desintegrasi membentuk unsur baru;
(3) memberikan spektrum warna jika dipanaskan;dan
(4) memancarkan sinar yang merusak plat foto yang ditutup dengan kertas film.
Sifat unsur radioaktif adalah nomor…..
A. 1 dan 2
B. 1 dan 3
C. 1 dan 4
D. 2 dan 3
E. 2 dan 4
Pembahasan
Sifat unsur radioaktif yang benar ditunjukkan nomor 2 dan 4.
Jawab : E
Soal no. 40
Berikut beberapa sifat unsur:
(1) larut dalam air membentuk larutan basa;
(2) titik leleh tinggi;
(3) membentuk molekul diatomik;dan
(4) oksidator kuat.
Sifat unsur halogen terdapat pada nomor….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan
Sifat unsur halogen yang benar ditunjukkan nomor 3 dan 4
Jawab : E








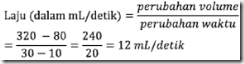




32 Komentar untuk "Soal Ujian Nasional Kimia SMA Tahun 2017 dan Pembahasannya"
daratulbasyariyah18@email.com
mariaulfam217@gmail.com
Rafiskater7@gmail.com
syakiragitaparera7@gmail.com
nurulhafiza2310@gmail.com
Shintadf28@gmail.com
Snafisaaa@gmail.com
frositadewi315@gmail.com
Alwanfarras100@gmail.com
padmayoni920@gmail.com
dhialc@yahoo.com
arochma14@gmail.com
marthasilaen51@gmail.com
riskauliaa16@gmail.com
Mohon dikirim ke dheairene23@gmail.com
Mohon dikirim ke dheairene23@gmail.com
Mohon dikirim ke dheairene23@gmail.com
mutieskaone@gmail.com
Yusephsh@gmail.com
fathirlanglang@gmail.com
alvians348@gmail.com
Sitinurulsaddiah@gmail.com
zaitunnisyabaso04@yahoo.com
erlinanurhasanah29@gmail.com
anggafaiz99@gmail.com
ichaazizah.naa@gmail.com
ahdi.mp1@gmail.com
tiaraindahnurk@gmail.com
nabilaRY01@yahoo.com
nadiaseptiana91@gmail.com
arrifqa.adawiyah@gmail.com
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)