1. Diketahui nomor atom unsur karbon, oksigen, natrium, belerang dan kalsium berturut-turut adalah 6, 8, 11, 16 dan 20. Unsur yang mempunyai jumlah elektron valensi paling sedikit adalah . . . .
A. karbon
B. oksigen
C. natrium
D. belerang
E. kalsium
2. Konfigurasi elektron unsur X: (Ar) 3d3 4s2
Dalam sistem periodik, unsur X tersebut terletak pada periode dan golongan . . .
A. 3 dan IIA
B. 3 dan IIIB
C. 4 dan IIA
D. 4 dan IIIB
E. 4 dan VB
3. Perhatikan gambar berikut:
Ikatan kovalen dapat terbentuk antara pasangan unsur . . . .
A. P dengan R
B. P dengan S
C. S dengan Q
D. S dengan T
E. P dengan S
4. Diketahui nomor atom unsur F = 9 dan I = 53. Maka geometri dan kepolaran molekul IF3 adalah . . . .
A. segi tiga sama sisi, non polar
B. tetrahedron, non polar
C. planar bentuk T, polar
D. piramida trigonal, polar
E. bipiramida trigonal, non polar
5. Perhatikan data percobaan berikut:
| No. | Massa besi yang direaksikan | Massa belerang yang direaksikan | Massa besi belerang | Massa pereaksi yang bersisa |
| 1 | 14 g | 8 g | 22 g | - |
| 2 | 3,5 g | 4 g | 5,5 g | 2 g belerang |
| 3 | 21 g | 4 g | 11 g | 14 g besi |
Massa besi belerang yang dapat terbentuk pada reaksi 10 gam besi dengan 4 gram belerang adalah . . . .
A. 4 gram
B. 7 gram
C. 10 gram
D. 11 gram
E. 14 gram
6. Urea dibuat dari reaksi amonia dengan karbon dioksida menurut persamaan reaksi
CO2 + 2NH3 → CO(NH2)2 + H2O
Massa urea yang dapat diperoleh jika direaksikan 1 kg amonia dengan 1 kg karbon dioksida adalah . . . . (H = 1; C = 12; N = 14; O = 16)
7. Perhatikan reaksi redoks berikut:
2KMnO4(aq) + 8H2SO4(aq) + 10KCl(aq)
® 2MnSO4(aq) + 6K2SO4(aq) + 5Cl2(aq) + 8H2O(aq)
Zat yang merupakan oksidator dan hasil oksidasi pada reaksi tersebut adalah . . . .
Oksidator Hasil oksidasi
A. KMnO4 MnSO4
B. H2SO4 K2SO4
C. KMnO4 Cl2
D. KCl MnSO4
E. KCl Cl2
8. Seorang siswa melakukan pengujian terhadap suatu sampel air limbah dan memperoleh data sebagai berikut:
| No. | Idikator yang digunakan | Trayek pH indikator | Warna sampel + indikator |
| 1 | Metil merah | 4 – 6 (merah-kuning) | Kuning |
| 2 | Metil jingga | 2 – 4 (merah – kuning) | Kunimg |
| 3 | Bromtimol biru | 6,2 – 7,6 (kuning – biru) | Biru |
| 4 | Fenolftalein | 8,3 – 10 (tidak berwarna – merah) | Tidak berwarna |
Berdasarkan data yang diperoleh, pH sampel air tersebut adalah sekitar . . . .
A. 4
B. 6
C. 7
D. 8
E. 10
9. Suatu larutan basa lemah MOH mempunyai konsentrasi 0,1M. Jika harga Kb basa lemah tersebut 1 x 10–5, maka pH larutan tersebut adalah . . . .
A. 1
B. 3
C. 5
D. 11
E. 13
10. Diketahui hasilkali kelarutan (Ksp) Mg(OH)2 = 4 x 10–12. Massa Mg(OH)2 yang dapat larut dalam 500 mL larutan NaOH 0,02 M adalah . . . . (H = 1; O = 16; Mg = 24).
A. 11,6 mg
B. 5,8 mg
C. 5,8 x 10–4 mg
D. 5,8 x 10–7 mg
E. 5,8 x 10–9 mg
11. Apabila ke dalam bejana yang berisi es ditambahkan kristal garam, maka . . . .
A. es mencair, suhu naik
B. es mencair, suhu turun
C. kristal garam larut, suhu naik
D. kristal garam larut, suhu tetap
E. kristal garam tidak larut, suhu tetap
12. Perhatikan diagram PT air berikut.
Apabila air pada titik tripelnya dinaikkan suhunya pada tekanan tetap, maka perubahan yang terjadi adalah . . . . A. mencair B. menyublim C. membeku D. menyublim dan menguap E. mencair dan menguap
13. Perhatikan berberapa cara pembuatan koloid berikut:
1. sol agar-agar dipanaskan, kemudian didinginkan
2. minyak kelapa dicampur dengan detergen, kemudian dikocok
3. belerang digerus dengan gula pasir, kemudian diaduk dengan air
4. gas H2S di alirkan ke dalam larutan As2O3
5. larutan FeCl3 ditambahkan ke dalam air mendidih
Pembuatan koloid yang tergolong cara kondensasi adalah . . . .
- 1 dan 2
- 2 dan 3
- 3 dan 4
- 4 dan 5
- 1 dan 3
14. Senyawa pembanding yang digunakan untuk menentukan nilai oktan bensin adalah n-heptana dan isooktana dengan ketentuan . . . .
A. isooktana diberi nilai oktan 0 karena tidak menimbulkan ketukan
B. n-heptana diberi nilai oktan 100 karena menimbulkan paling banyak ketukan
C. isooktana diberi nilai oktan 100 karena menimbulkan ketukan paling sedikit
D. isooktana diberi nilai oktan 100 karena tidak menimbulkan ketukan
E. n-heptana diberi nilai oktan 0 karena tidak menimbulkan ketukan
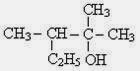
15. Senyawa karbon dengan rumus molekul C3H8O, mempunyai sifat-sifat sebagai berikut:
1. bereaksi dengan natrium menghasilkan gas hidrogen
2. dengan larutan kalium dikromat mengasilkan aseton
Gugus fungsi dalam senyawa itu adalah . . . .
A. –OH
B. –O–
C. –COOH
D. –CHO
E. –CO–
16. Perhatikan struktur dari beberapa senyawa berikut:
Senyawa tersebut yang mempunyai keisomeran optik adalah . . . .
A. (1), (2) dan (3)
B. (1) dan (3)
C. (2) dan (4)
D. (4) saja
E. (1), (2), (3) dan (4)
17. Orang yang mengkonsumsi minuman beralkohol tradisional seringkali mengalami kebutaan, bahkan kematian. Dapat diduga bahwa minuman yang mereka konsumsi mengandung . . . .
A. metanol .
B. etanol
C. gliserol
D. glikol
E. formalin
18. Perhatikan rumus senyawa berikut. Nama yang tepat untuk senyawa itu adalah . . . .
A. 2-etil-3-metil-3-butanol B. 2,3-dimetil-4-pentanol C. 2,3-dimetil-2-pentanol D. 1,1,2-trimetil-1-butanol E. 3-etil-2-metil-2-butanol
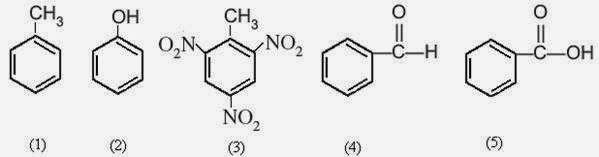
19. Perhatikan struktur dari beberapa senyawa turunan benzen aberikut:
Yang digunakan sebagai bahan pengawet makanan adalah . . . .
- (1)
- (2)
- (3)
- (4)
- (5)
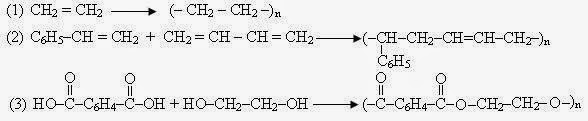
20. Perhatikan reaksi-reaksi pembuatan polimer berikut:
Pebentukan polimer yang berdasarkan reaksi kondensasi adalah . . . .
A. (1)
B. (2)
C. (3)
D. (1) dan (2)
E. (1), (2) dan (3)
21. Suatu karbohidrat mempunyai rumus molekul C12H22O11, tidak mereduksi pereaksi Fehling dan pada reaksi hidrolisis menghasilkan dua jenis monosakharida. Senyawa tersebut adalah . . . .
A. sukrosa
B. maltosa
C. laktosa
D. glukosa
E. fruktosa
22. Pada percapuran 50 mL larutan NaOH M dengan 50 mL larutan HCl 1M terjadi kenaikan suhu 6ºC. Jika diketahui kalor jenis larutan 4,2 J g–1 K–1, maka perubahan entalpi reaksi
NaOH(aq) + HCl(aq) ® NaCl(aq) + H2O(l)
adalah . . . .
A. –1,26 kJ
B. –2,52 kJ
C. –25,2 kJ
D. –50,4 kJ
E. –100,8 kJ
23. Di antara persamaan termokimia berikut yang perubahan entalpinya dapat dikatakan sebagai entalpi pembentukan adalah . . . .
A. 2H(g) + O(g) ® H2O(l) DH = -926 kJ
B. H+(aq) + OH–(aq) ® H2O(l) DH = -54 kJ
C. C2(s) + 2H2(g) ® C2H4(g) DH = +54 kJ
D. H2(g) + ½ O2(g) ® H2O(g) DH = -242 kJ
E. 2H2(g) + O2(g) ® 2H2O(g) DH = -484 kJ
24. Diketahui persamaan termokimia sebagai berikut:
H2(g) + F2(g) ® 2HF(g) DH = -540 kJ
C(s) + 2F2(g) ® CF4(g) DH = -680 kJ
2C(s) + 2H2(g) ® C2H4(g) DH = +50 kJ
Berdasarkan data tersebut, maka perubahan entalpi reaksi berikut adalah . . . .
C2H4(g) + 6F2(g) ® 2CF4(g) + 4HF(g)
A. 1170 kJ
B. 1270 kJ
C. 2490 kJ
D. 2530 kJ
E. 2630 kJ
25. Diketahui:
2H2(g) + O2(g) → 2H2O(g) ∆H = – 480 kJ
Energi ikatan O=O : 500 kJ mol–1
H – H : 430 kJ mol–1
Dapat ditentukan energi ikatan O – H dalam air adalah . . . .
A. 220 kJmol–1
B. 440 kJ mol –1
C. 460 kJ mol–1
D. 960 kJ mol–1
E. 1840 kJ mol–1
26. Propil energi suatu reaksi sebagai berikut:
Energi pengaktifan reaksi tersebut adalah . . . .

27. Perhatikan data percobaan berikut:
P(aq) + Q(aq) → R(aq)
| No. | Konsentrasi awal | Waktu reaksi (det) | |
| P (M) | Q (M) | ||
| 1 | 0,1 | 0,1 | 180 |
| 2 | 0,2 | 0,1 | 45 |
| 3 | 0,3 | 0,1 | 20 |
| 4 | 0,1 | 0,3 | 60 |
Berdasarkan data di atas, maka persamaan laju adalah . . . .
A. v = k [P] D. v = k [P]2[Q]
B. v = k [P][Q] E. v = k [P]2[Q]2
C. v = k [B][Q]2
28. Kesetimbangan yang bergeser ke arah produk apabila tekanan diperbesar pada suhu tetap adalah . . . .
E. CH3COOH(aq) CH3COO–(aq) + H+(aq)
29. Sebanyak 2 mol N2O4 dipanaskan dalam ruangan 5 liter sehingga membentuk kesetimbangan
Kesetimbangan tercapai ketika 50% N2O4 telah terurai. Tetapan kesetimbangan (Kc) pada suhu itu adalah . . . .
A. 0,2
B. 0,4
C. 0,6
D. 0,8
E. 1,0
30. Oksidasi asam oksalat oleh kalium permanganat dalam suasana asam menurut persamaan sebagai berikut:
aMnO4–(aq) + bH2C2O4(aq) + cH+(aq) → dMn2+(aq) + eCO2(g) + fH2O(l)
Nilai koefisien reaksi a, b, c, d dan e berturut-turut adalah . . . .
A. 1, 3, 6, 1, 3
B. 2, 3, 8, 2, 6
C. 2, 5, 6, 2, 10
D. 2, 5, 6, 2, 6
E. 2, 5, 8, 2, 10
31. Diketahui potensial elektrode Zn dan Cu sebagai berikut:
Zn2+(aq) + 2e ¾® Zn(s) Eº = – 0,76 volt
Ag+(aq) + e ¾® Ag(s) Eº = + 0,80 volt
Potensial standar sel yang menggunakan kedua elekrode tersebut adalah . . . .
A. 0,04 volt
B. 0,76 volt
C. 0,80 volt
D. 1,56 volt
E. 2,36 volt
32. Reaksi yang terjadi di katode adalah . . . .
Perhatikan sel elektrolisis berikut:
33. Peleburan aluminium dilakukan dengan elektrolisis lelehan Al2O3. Reaksi katodenya adalah sebagai berikut:
Al3+(l) + 3e → Al(l)
Massa alumnium (Ar = 27) yang dapat diperoleh dalam satu jam dari 1000 sel dengan kuat arus 96,5 amper adalah . . . .
A. 3,24 g
B. 97,2 g
C. 32,4 kg
D. 97,4 kg
E. 32400 kg
34. Kaleng kemasan dibuat dari baja yang dilapisi dengan timah. Mengingat potensial reduksi Fe2+/Fe = –0,44 volt dan Sn2+/Sn = –0,13 volt, maka alasan pemilihan timah berdasarkan sifat timah:
(1) tahan karat
(2) lebih mudah berkarat daripada besi
(3) dapat mendorong perkaratan kaleng bekas
(4) dapat memberi perlindungan katode pada besi
Pernyataan yang benar adalah . . . .
- (1), (2) dan (3)
- (1) dan (3)
- (2) dan (4)
- (4) saja
- (1), (2), (3) dan (4)
35. Sepotong logam natrium dimasukkan ke dalam air yang telah diberi fenolftalin. Natrium segera larut disertai timbulnya api sementara larutan menjadi berwarna merah dadu. Reaksi yang terjadi adalah . . . .
A. 2Na(s) + H2O(l) ® Na2O(s) + 2H2(g) + energi
B. 4Na(s) + 2H2O(l) ® 4NaH(s) + O2(g) + energi
C. 2Na(s) + 2H2O(l) ® 2NaOH(aq) + H2(g) + energi
D. 2Na(s) + 3H2O(l) ® Na2O(s) + 3H2(g) + O2(g) + energi
E. 2Na(s) + 2H2O(l) ® Na2O2(s) + 2H2(g) + energi
36. A, B dan C adalah unsur periode-3 dengan sifat-sifat sebagai berikut.
| Unsur | Wujud pada suhu kamar | Dayahantar listrik | Kelarutan dalam air | Kelarutan dalam asam | Kelarutan dalam basa |
| A | Padat | Konduktor | Larut | Larut | Tidak larut |
| B | Padat | Non konduktor | Tidak larut | Tidak larut | Tidak larut |
| C | Padat | Konduktor | Tidak larut | Larut | Larut |
Urutan letak unsur-unsur itu pada periode-3, dari kiri ke kanan adalah . . . .
- A – B – C
- A – C – B
- B – A – C
- B – C – A
- C – A – B
37. Unsur transisi yang digunakan untuk membuat kuningan adalah . . . .
- Cr dan Fe
- Mn dan Co
- Zn dan Sn
- Cu dan Zn
- Cu dan Sn
38. Pada peleburan besi digunakan kokas dan batu kapur (CaCO3). Fungsi dari kedua bahan tersebut adalah . . . .
Kokas Batu Kapur
- reduktor mengikat pengotor
- oksidator mengikat pengotor
- reduktor oksidator
- bahan bakar reduktor
- mengikat pengotor reduktor
39. Suatu larutan yang tidak berwarna menjadi coklat setelah ditambah air klor. Jika larutan coklat ini dikocok dengan CH3CCl3 terbentuk lapisan berwarna ungu. Berdasarkan hasil percobaan tersebut dapat disimpulkan bahwa larutan mula-mula mengandung ion . . . .
- ClO-
- Br-
- I-
- Cl-
- F-
40. Data tentang kegunaan senyawa halogen:
Senyawa Kegunaan
1. NaClO a. mencegah penyakit gondok
2. CHI3 b. antiseptik
3. AgI c. refrigeran
4. CF2Cl2 d. pemutih
5. NaIO3 e. fotografi
Pasangan yang benar adalah . . . .
- 1 dengan c
- 2 dengan b
- 3 dengan a
- 4 dengan d
- 5 dengan e







9 Komentar untuk "Soal UN KIMIA Kelas XII bag.18"
ada pembahasannya ga?
Nomer 11 jawabannya apa ya?
Makasi
elly.dahlia1974@gmail.com
Ada pembahasannya ngga
nandaaurelia8@gmail.com
Gak ada jwabannya?
syahranimksr@gmail.com
tolong pembahasannya
tolong pembahasannya
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)