Sifat yang berubah secara beraturan menurut kenaikan nomor atom dari kiri ke kanan dalam satu periode dan dari atas ke bawah dalam satu golongan disebut sifat periodik. Sifat periodik meliputi jari-jari atom, energi ionisasi, afinitas electron dan keelektronegatifan.
Jari-Jari Atom
Jari-jari atom adalah jarak dari inti atom hingga kulit terluar. Jari-jari atom sulit untuk ditentukan apabila unsur berdiri sendiri tanpa bersenyawa dengan unsur lain. Jari-jari atom secara lazim ditentukan dengan mengukur jarak dua inti atom yang identik yang terikat secara kovalen. Pada penentuan jari-jari atom ini, jari- jari kovalen adalah setengah jarak antara inti dua atom identik yang terikat secara kovalen.
Penentuan jari-jari atom dalam satu golongan :
Kurva hubungan jari-jari atom dengan nomor atom memperlihatkan bahwa jari-jari atom dalam satu golongan akan semakin besar dari atas ke bawah. Hal ini terjadi karena dari atas ke bawah jumlah kulit bertambah sehingga jari-jari atom juga bertambah.
Unsur-unsur dalam satu periode (dari kiri ke kanan) berjumlah kulit sama tetapi jumlah proton bertambah sehingga jari-jari atom juga berubah. Karena jumlah proton bertambah maka muatan inti juga bertambah yang mengakibatkan gaya tarik menarik antara inti dengan elektron pada kulit terluar semakin kuat. Kekuatan gaya tarik yang semakin meningkat menyebabkan jari-jari atom semakin kecil. Sehingga untuk unsur dalam satu periode, jari-jari atom semakin kecil dari kiri ke kanan.
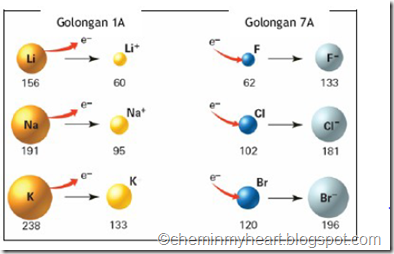
Jari-jari ion digambarkan sebagai berikut:
Energi Ionisasi
Energi minimum yang dibutuhkan untuk melepas elektron atom netral dalam wujud gas pada kulit terluar dan terikat paling lemah disebut energi ionisasi. Nomor atom dan jarijari atom mempengaruhi besarnya energi ionisasi. Semakin besar jari-jari atom maka gaya tarik antara inti dengan elektron pada kulit terluar semakin lemah. Hal ini berarti elektron pada kulit terluar semakin mudah lepas dan energi yang dibutuhkan untuk melepaskan elektron tersebut semakin kecil. Akibatnya, dalam satu golongan, energi ionisasi semakin kecil dari atas ke bawah. Sedagkan dalam satu periode, energi ionisasi semakin besar dari kiri ke kanan. Hal ini disebabkan dari kiri ke kanan muatan itu semakin besar yang mengakibatkan gaya tarik antara inti dengan elektron terluar semakin besar sehingga dibutuhkan energi yang besar pula untuk melepaskan elektron pada kulit terluar.
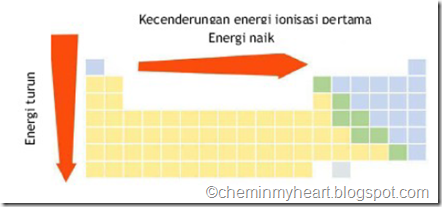
Hubungan energi ionisasi dengan nomor atom adalah sebagai berikut :
Kurva tersebut menunjukkan unsur golongan 8A berada di puncak grafik yang mengindikasikan bahwa energi ionisasinya besar. Hal sebaliknya terjadi untuk unsur golongan 1A yang berada di dasar kurva yang menunjukkan bahwa energi ionisasinya kecil. Atom suatu unsur dapat melepaskan elektronnya lebih dari satu buah. Energi yang dibutuhkan untuk melepaskan elektron keua disebut energi ionisasi kedua dan tentu saja diperlukan energi yang lebih besar. Energi ionisasi semakin besar apabila makin banyak elektron yang dilepaskan oleh suatu atom.
Afinitas Elektron
Afinitas elektron merupakan enegi yang dilepaskan atau diserap oleh atom netral dalam bentuk gas apabila terjadi penangkapan satu elektron yang ditempatkan pada kulit terluarnya dan atom menjadi ion negatif. Afinitas elektron dapat berharga positif dan negatif. Afinitas elektron berharga negatif apabila dalam proses penangkapan satu elektron, energi dilepaskan. Ion negatif yang terbentuk akibat proses tersebut bersifat stabil. Hal sebaliknya terjadi apabila dalam proses penangkapan satu elektron, energi diserap. Penyerapan energi menyebabkan ion yang terbentuk bersifat tidak stabil. Semakin negatif harga afinitas lektron suatu atom unsur maka ion yang terbentuk semakin stabil.
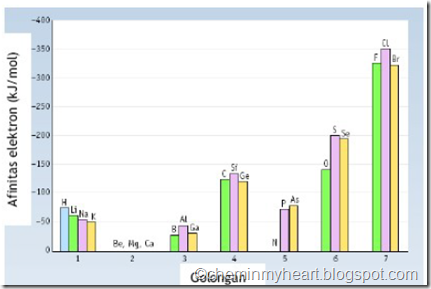
Gambar menunjukkan bahwa atom unsur golongan 2A dan 8A mempunyai afinitas elektron yang berharga positif. Hal ini mengindikasikan bahwa unsur golongan 2A dan 8A sulit menerima elektron. Afinitas elektron terbesar dimiliki oleh unsur golongan halogen karena unsur golongan ini paling mudah menangkap elektron. Jadi secara umum dapat dikatakan bahwa afinitas elektron, dalam satu periode, dari kiri ke kanan semakin negatif dan dalam satu golongan dari atas ke bawah, semakin positif.
Keelektronegatifan
Keelektronegatifan ada-lah skala yang dapat menjelaskan kecenderungan atom suatu unsur untuk menarik elektron menuju kepadanya dalam suatu ikatan. Keelektronegatifan secara umum, dalam satu periode, dari kiri ke kanan semakin bertambah dan dalam satu golongan, dari atas ke bawah keelekrnegatifan semakin berkurang. Hal ini dapat dimengerti karena dalam satu periode, dari kiri ke kanan, muatan inti atom semakin bertambah yang mengakibatkan gaya tarik antara inti atom dengan elektron terluar juga semakin bertambah. Fenomena ini menyebabkan jari-jari atom semakin kecil, energi ionisasi semakin besar, afinitas elektron makin besar dan makin negatif dan akibatnya kecenderungan untuk menarik elektron semakin besar.
Elektronegatifitas
Terlihat dari gambar bahwa untuk unsur gas mulia tidak mempunyai harga keelektronegatifan karena konfigurasi elektronnya yang stabil. Stabilitas gas mulia menyebabkan gas mulia sukar untuk menarik dan melepas elektron. Keelektronegatifan skala pauling memberikan nilai keelektronegatifan untuk gas mulia sebesar nol.









0 Komentar untuk "SIFAT-SIFAT KEPERIODIKAN UNSUR"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)