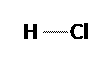
Marilah kita perhatikan senyawa yang terbentuk dari sesama unsur nonlogam, misalnya HCl dan H2O,atau unsur yang partikelnya berupa molekul, misalnya H2 dan Cl2. Antarsesama atom nonlogam tidak mungkin terjadi serah terima elektron karena keelektronegatifannya hampir atau bahkan sama. Jadi, bagaimanakah atom-atom dalam zat tersebut saling berikatan?
Selain dengan cara serah-terima elektron seperti yang terjadi pada ikatan ion, konfigurasi oktet ternyata juga dapat dicapai dengan memasangkan elektron valensinya. Oleh karena mempunyai keelektronegatifan yang relatif besar, unsur-unsur nonlogam cenderung menarik elektron. Sebagai contoh, marilah kita perhatikan pembentukan ikatan dalam molekul hidrogen (H2).
Masing-masing atom H mempunyai 1 elektron. Untuk mencapai konfigurasi stabil gas mulia terdekat, yaitu He (Z=2), dua atom hidrogen saling memasangkan elektron valensinya. Pasangan elektron tersebut menjadi milik bersama, artinya ditarik oleh kedua inti atom yang berikatan. Dengan demikian, kedua atom tersebut menjadi saling terikat. Ikatan yang terbentuk karena penggunaan bersama pasangan elektron disebut ikatan kovalen.
Cara atom-atom saling mengikat dalam suatu molekul dinyatakan dengan rumus bangun atau rumus struktur. Rumus struktur diperoleh dari rumus Lewis dengan mengganti setiap pasangan elektron iakatan dengan sepotong garis. Perhatikanlah rumus Lewis dan rumus bangun beberapa molekul berikut.
Dua etom dapat membentuk ikatan denga sepasang, dua pasang atau tiga pasang elektron bergantung pada jenis unsur yang berikatan. Ikatan yang menggunakan sepasang elektron disebut ikatan tunggal, yang menggunakan dua pasang elektron disebut ikatan rangkap, sedangkan yang menggunakan tiga pasang elektron disebut ikatan rangkap tiga. Perhatikanlah beberapa contoh berikut.
Contoh 1:
Ikatan rangkap dalam molekul CO2.
Konfiguarasi elektron C (Z = 6) dan O (Z = 8):
C : 2 4 (memerlukan 4 elektron)
O : 2 6 (memerlukan 2 elektron)
Dalam CO2, atom C memasangkan 4 elektron sedangkan atom O memasangkan 2 elektron. Oleh karena itu, 1 atom C berikatan dengan 2 atom O. Pembentukan ikatannya dapat digambarkan sebagai berikut.
Contoh 2:
Ikatan rangkap tiga dalam molekul N2.
Nitrogen mempunyai 5 elektron valensi, sehingga harus memasangkan 3 elektron. Pembentukan ikatannya dapat digambarkan sebagai berikut.
Ikatan kovalen sendiri merupakan ikatan yang terjadi antar atom dengan cara memasangkan elektron valensinya. Ikatan kovalen ini biasanya terjadi antar unsur nonlogam, karena masing-masing atom mempunyai keelektronegatifan yang relatif besar. Masing-masing atom dalam ikatan kovalen saling memasangkan elektron valensinya, sehingga pasangan elektron tersebut mejadi milik bersama atau ditarik oleh kedua inti atom yang berikatan.
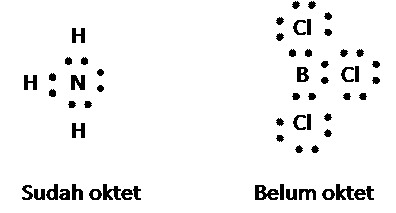
Sekarang, mari kita perhatikan senyawa NH3.BCl3 yang terbentuk dari reaksi amonia (NH3) dengan boron triklorida (BCl3). Bagaimanakah bentuk ikatan antara dua molekul tersebut? Perhatikan rumus elektron dari NH3 dan BCl3 berikut ini.
Atom N dalam NH3 sudah oktet dan mempunyai sepasang elektron bebas. Di pihak lain, atom B dalam BCl3 sudah memasangkan semua elektron valensinya, namun belum oktet. Atom N (dari NH3) dan atom B (dari BCl3) dapat berikatan dengan menggunakan bersama pasangan elektron bebas dari atom N. Ikatan seperti itu kita sebut ikatan kovalen koordinat atau ikatan dativ atau ikatan semipolar. Dalam menggambarkan struktur molekul, ikatan kovalen koordinat dinyatakan dengan garis berpanah dari atom donor menuju akseptor pasangan elektron. Rumus elektron dan rumus struktur NH3.BCl3 sebagai berikut.
Untuk lebih jelasnya, perhatikanlah contoh berikut ini.
Ikatan kovalen koordinat dalam ion NH4+
NH4+ terbentuk dari reaksi antara NH3 dengan ion H+. atom N dalam NH3 mempunyai sepasang elektron bebas, sementara ion H+ sudah tidak mempunyai elektron. Elektron bebas dari atom N kemudian digunakan bersama dengan ion H+.
SOAL IKATAN KOVALEN
Diketahui nomor atom dari :
H = 1
C = 6
N = 7
F = 9
Cl = 17
1. Tuliskan konfigurasi masing-masing unsur tersebut !
H :
C :
N :
F :
Cl:
2. Gambarkan struktur Lewis dari masing- masing unsur tersebut !
3. Dengan mengacu pada aturan oktet, ramalkan rumus kimia senyawa yang dapat dibentuk dari:
a. H dengan F
b. N dengan Cl
c. C dengan H
d. C dengan Cl
e. F dengan Cl








1 Komentar untuk "Mengenal Ikatan Kovalen"
Berkomentarlah dengan baik dan sopan, saya akan berusaha untuk menjawab setiap pertanyaan dan menanggapi setiap komentar yang anda berikan, :)
Terimakasih atas kunjungan dan komentarnya :)